(10分)化合物I是一种药物合成中间体,与I相关的反应如下:
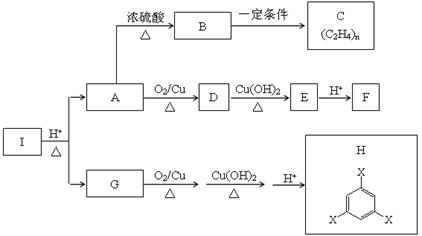
根据以上信息回答下列问题。
(1)写出A中所含官能团的名称 ;B→C的反应类型是 。
(2)写出D→E的化学方程式 。
(3)工业上用B与O2在催化剂条件下生产环氧乙烷,化学反应方程式为 。
(4)实验室取1.96g G完全燃烧,将燃烧产物通过碱石灰,碱石灰质量增加4.68g;若将燃烧产物通过浓硫酸,浓硫酸的质量增加0.72g。G的分子式是 。
(5)已知化合物I分子式中碳原子数为13,则化合物H的结构简式是 。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(OH-)____0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
①试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
②将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。试回答以下问题:
(1)电极A的名称是 。
(2)甲装置中电解反应的总化学方程式是
。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH =__________。
(4)欲用丙装置给铜镀银,G应该是 (填“银”或“铜”),电镀液的主要成分是(填化学式) 。
(1)某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为: ;
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 ;
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为: ;
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________;
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________;