硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: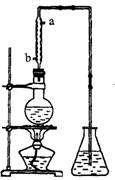
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入,目的是。
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物。下列框图是分离操作步骤流程图:
则试剂a是:____________,分离方法I是____________,试剂b是______________,分离方法III是____________。
(4)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙 两人实验结果如下:甲得到了显
两人实验结果如下:甲得到了显 酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为上述实验没有成功。试分析下列问题:
酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为上述实验没有成功。试分析下列问题:
①甲实验失败的原因__________________________________________________________
②乙实验失败的原因是_________________________________________________________
下列实验操作不正确的是
①用分液漏斗分离环己烷和苯的混合液体
②将10滴溴乙烷加入到1 mL 10%的烧碱溶液中,加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
③配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
④实验室制溴苯时选用的试剂可以是溴水、苯和铁屑
⑤分离苯和苯酚的混合液,可加入适量浓溴水,过滤、分液,即可实现。
实验题:
今欲用NaHCO3固体配制500mL 0.2mol/L的NaHCO3溶液。根据题意填空: (1)配制该溶液应选用mL容量瓶
(1)配制该溶液应选用mL容量瓶 (2)用托盘天平称取g固体NaHCO3
(2)用托盘天平称取g固体NaHCO3 (3)将称好的NaHCO3固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(3)将称好的NaHCO3固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。 (4)用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀。
(4)用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀。 (5)向容量瓶中加入蒸馏水,直到液面离刻度线约2-3厘米时,改用滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约2-3厘米时,改用滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。 (6)
(6) 以下因素会造成实验结果偏低的是()
以下因素会造成实验结果偏低的是()
| A.定容时观察液面仰视 | B.定容时观察液面俯视 |
| C.没有第(4)步的用蒸馏水洗涤烧杯 | D.容量瓶中原来有少量蒸馏水 |
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: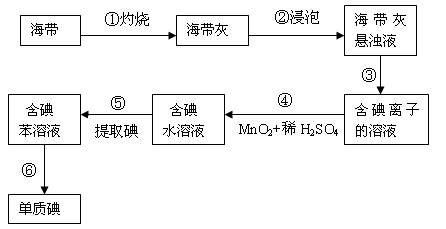
(1)步骤④中需用到1mol/L的稀硫酸100mL,若用98%,密度为1.84g/cm3的浓硫酸来配制,则应用量筒量取浓硫酸的体积是。
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)步骤⑤中选择用苯而不用酒精来提取碘的理由是。
(4)查阅资料:该小组同学知道海带中的碘元素主要以有机碘化物的形式存在,若该小组实验时称得海带的质量为ag,提取碘的过程中碘损失了m%,最后得到单质碘的质量为bg,该小组同学测得的海带中碘的含量为(用含a、b、m的式子表示)。
 实验
实验 室用下图装置制取少量溴苯,填写下列空白
室用下图装置制取少量溴苯,填写下列空白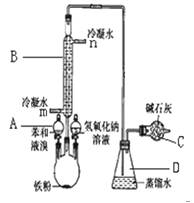
(1).写出仪器A的名称;B的名称; (2).请你写出实验室制取溴苯的化学方程式;
(2).请你写出实验室制取溴苯的化学方程式;
(3).长导管的下口为什么不插入锥形瓶的液面下
(4).反应完后,向烧瓶中加NaOH  溶液的作用是:
溶液的作用是:
(5).冷凝水的进水口是(填m或n),