下列实验操作不正确的是
①用分液漏斗分离环己烷和苯的混合液体
②将10滴溴乙烷加入到1 mL 10%的烧碱溶液中,加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
③配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
④实验室制溴苯时选用的试剂可以是溴水、苯和铁屑
⑤分离苯和苯酚的混合液,可加入适量浓溴水,过滤、分液,即可实现。
为证明草木灰的主要成分是K2CO3,设计如下实验:
(1)提取碳酸钾晶体,可供选择的实验操作步骤有:
A过滤B溶解C浓缩结晶D蒸发E冷却结晶F萃取G蒸馏.按照操作顺序,应选择有__________(写编号)在实验中都要用到的仪器是____________.
(2)鉴定提取的晶体是碳酸钾________________________.
用下面两种方法可以制得白色的Fe(OH)2:沉淀方法一:用不含Fe2+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。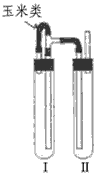
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 ______________。
(2)除去蒸馏水中溶解的O2常采用 的方法_______________。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____________ 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 _______________。
(2)在试管Ⅱ里加入的试剂是_______________ 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是___________ 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 __________。
在氯化铵溶液中撒入镁粉有何现象?并分析其原因。