欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
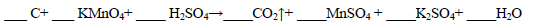
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
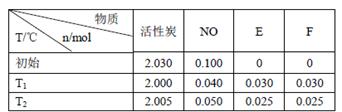
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
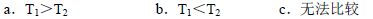
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: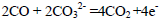 则
则
正极反应式:___ ,电池总反应式 。
(共16分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)  xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。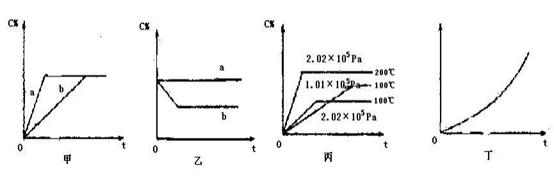
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则曲线表示无催化剂时的情况,速率:ab(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则曲线表示恒温恒容的情况,此时该恒温恒容中
C%(填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是热反应(填:放热、吸热),计量数x的值是;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是,[填:①C% ②A的转化率③B的转化率④压强⑤c(A)⑥c(B)];升温平衡移动的方向为。(填:左移或右移)
已知A(g)+B(g)  C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。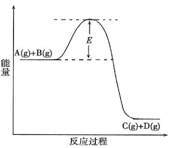
(1)该反应是_________反应(填“吸热”、“放热”)。当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂,反应速率增大,E的变化是_________,(填“增大”、“减小”或“不变”)理由是E的大小对该反应的反应热有无影响?。
已知
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
CuCl2溶液有时呈黄色,有时呈绿色或蓝色,原因是CuCl2的水溶液中存在平衡:
[Cu(H2O)4]2++4C1- [CuC14]2-+4H2O
[CuC14]2-+4H2O
(蓝色)(黄色)
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法(是离子反应的并用离子方程式表示):
(1)(2)
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_______________________________。
(2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为_______________________________。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。