【改编】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
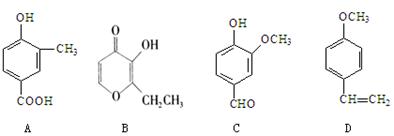
(1)D中含有的官能团的名称是 ;化合物B的分子式是 ;
(2)化合物D的核磁共振氢谱中出现 组峰;
(3)1mol A分别与足量金属钠、碳酸钠反应产生气体的体积比为 ;1molC完全燃烧消耗标准状况下氧气的体积为 ;
(4)A与乙二醇(HOCH2CH2OH)以物质的量2:1反应生成一种酯和水,请写出该反应的化学方程式(注明反应条件): 。
(5)符合下列条件的有机物C的同分异构体有___种:
①能够发生银镜反应;
②能够使FeCl3溶液显紫色;
③苯环有两个取代基
将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为g。
M(NO3)2热分解化学方程式为2M(NO3)2==2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是_________。
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是 ________,________。
已知:R—CH===CH—O—R′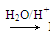 R—CH2CHO+
R—CH2CHO+
(烃基烯基醚)
R′OH,烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4,与A相关的反应如下:
请回答下列问题:
(1)A的分子式为________.
(2)B的名称是________;A的结构简式为________.
(3)写出C―→D反应的化学方程式:______________________________________
________________________________________________________________________.
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:________、________.
①属于芳香烃;
②苯环上有两种不同环境的氢原子.
有机物A为茉莉香型香料
(1)A分子中含氧官能团的名称是____________.
(2)C的分子结构可表示为(其中R和R′代表不同的烃基):
A的化学式是__________,A可以发生的反应是________________(填字母序号).
a.还原反应 b.加成反应 c.氧化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________________.
(4)A分子结构中只有一个甲基,A的结构简式是_____________________________
________________________________________________________________________.