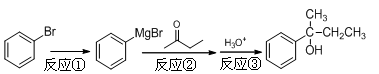
[实验化学]2-苯基-2-丁醇是重要的有机合成中间体,以溴苯为原料合成该中间体的反应原理如下:
【实验装置】

【实验步骤】
步骤1:将镁条置于装置Ⅰ的三颈烧瓶中,加入100 mL乙醚(ρ=0.71g·cm-3),在冷却条件下缓缓滴入溴苯,微热并加入一小块碘引发反应①。
步骤2:滴加14.2 mL丁酮和30 mL乙醚混合物,发生反应②;滴加入20%的NH4Cl水溶液,发生反应③。
步骤3:分出油层,用水洗涤至中性,用无水CaCl2干燥。
步骤4:用装置Ⅱ先蒸出乙醚,再蒸馏出产品。
(1)步骤1中加入碘的作用是 。
(2)装置Ⅰ中滴加液体所用的仪器的名称是 ,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,其目的是 。
(3)步骤三中分离出油层的具体实验操作是 。
(4)装置Ⅱ采用的是减压蒸馏,实验时需将吸滤瓶需连接 ;采用这种蒸馏方式的原因是 。
某固体混合物可能含有
、
、
、
和
,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填"无")。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
| 1. |
(1)将少许固体放入水中得到无色溶液和白色沉淀。
|
| 2. |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
| 3. |
(4)通过上述实验仍无法确定的物质是 |
某课外小组利用
还原黄色的
粉末测定
的相对原子质量,下图是测定装置的示意图,
中的试剂是盐酸。
请回答下列问题。
(1)仪器中装入的试剂:
、
、
;
(2)连接好装置后应首先;
(3)"加热反应管
"和"从
瓶逐滴滴加液体"这两步操作应该先进行的是:。在这两步之间还应进行的操作是;
(4)反应过程中
管逸气体是,其处理方法是:_。
(5)从实验中测得了下列数据
①空
管的质量
②
管和
的总质量
③反应后
管和
粉的总质量
(冷却到室温称量)
④反应前
管及内盛物的总质量
⑤反应后
管及内盛物的总质量
由以上数据可以列出计算
的相对原子质量的两个不同计算式(除
外,其他涉及的元素的相对原子质量均为已知):
计算式1:
=;计算式2:
=。
某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
实验目的
测定食醋的总酸量
实验原理
中和滴定
实验用品
蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g /100mL),
0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
实验步骤
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
数据记录
| 滴定次数 实验数据 |
1 |
2 |
3 |
4 |
| V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V (NaOH)始/mL |
0.00 |
0.20 |
0.10 |
0.10 |
| V (NaOH)终/mL |
14.98 |
15.20 |
15.12 |
16.24 |
问题与思考
⑴ 步骤①中中还需补充的仪器有▲。蒸馏水的处理方法是▲。
⑵ 步骤③中你选择的酸碱指示剂是▲,理由是▲。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是▲。
⑷ 样品总酸量=▲ g/100mL。
有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,另外测得这种气体密度为同温、同压下氧气密度的1.375倍。B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热得到C,C在高温时软化,无固定熔点。







根据以上事实,判断A为哪种元素的单质?B、C各是什么物质?写出有关反应的化学方程式。
现有一种简单可行的测定阿伏加德罗常数的方法,具体步骤为:⑴将固体NaCl细粒干燥后,准确称取m克NaCl固体并转移到定容仪器A中;⑵用滴定管向仪器A中加苯,不断振荡,继续加苯至A仪器的刻度处计算出NaCl固体的体积为Vml,请回答下列问题:
⑴步骤⑴中A仪器最好用
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
⑵步骤⑵中用酸式滴定管还是碱式滴定管,理由是;
⑶能否用水代替苯,理由是。
⑷已知NaCl晶体中,靠得最近的钠离子与氯离子间的平均距离为a cm,用上述方法测得的阿伏加德罗常数的表达式为