某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
实验目的
测定食醋的总酸量
实验原理
中和滴定
实验用品
蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g /100mL),
0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
实验步骤
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
数据记录
| 滴定次数 实验数据 |
1 |
2 |
3 |
4 |
| V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V (NaOH)始/mL |
0.00 |
0.20 |
0.10 |
0.10 |
| V (NaOH)终/mL |
14.98 |
15.20 |
15.12 |
16.24 |
问题与思考
⑴ 步骤①中中还需补充的仪器有 ▲ 。蒸馏水的处理方法是 ▲ 。
⑵ 步骤③中你选择的酸碱指示剂是 ▲ ,理由是 ▲ 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 ▲ 。
⑷ 样品总酸量= ▲ g/100mL。
用下列两个装置分别进行苯的硝化和苯酚跟甲醛的缩聚实验.
(1)(甲)装置适用于进行 实验.,本实验需要的药品为6
实验.,本实验需要的药品为6 3%
3% 的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
若温度控制在50—600C,其反应的化学方程式为————————;
(2)(乙)装置适用于进行实验.,其化学方程式为—————。
(3)写出苯酚与浓溴水反应的化学方程式
(2分)下列实验操作不正确的是________。
陇东中学高三2、4班学生设计了以下 实验方案验证Ag与浓HNO3反应的
实验方案验证Ag与浓HNO3反应的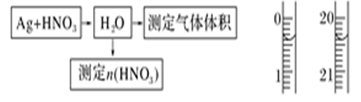
⑴测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶 液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置
液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置 如上图所示。在B容器中生成硝酸的物质的量为__
如上图所示。在B容器中生成硝酸的物质的量为__ __________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
⑵测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是____________________________________________________________
__________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________________________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是________________________________。
固态化 合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。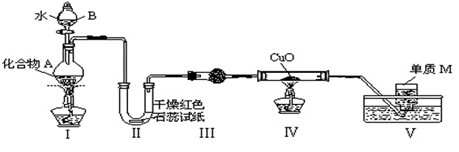
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有气体M生成,则Ⅳ发生反应的化学方程式为______________________________;Ⅲ中的试剂为__________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ——Ⅲ——Ⅳ——Ⅱ——Ⅴ,此时Ⅱ中现象为__________________,原因是_______________________________________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为_____________。
纯净的NO是无色气体,很容易与许多分子发生反应。在有生命的有机体中会不断地产生NO,并被用来在细胞内和细胞间传递信息。它还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。试回答下列问题:
(1)实验室制取NO的化学方程式:。
(2)收集NO气体应采用法,若采用此法收集NO气体,应从装置A的端进气(填“a”或者“b”)。
(3)甲同学用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图I: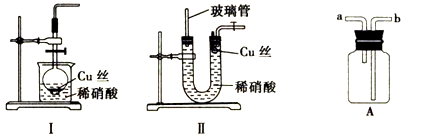
打开分液漏斗的活塞使反成进行,能否制得纯净的NO气体?(填“能”或者“不能”);若不能,原因是(用化学方程式表示)。
(4)为证明铜丝与稀硝酸反应生成的是NO,乙同学另设计了一套制取NO的装置,如图Ⅱ:
①让反应停下的操作是;
②长玻璃管的作用是。