硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
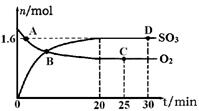
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的方程式为:
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时我觉得还需加入来防止Fe2+被氧化。
(2)除去蒸馏水中溶解的O2常采用的方法。
(3)检验Fe3+的最佳试剂是,简述其检验方法:。
2016年奥运会将在里约热内卢举行,下图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成。A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2。
(1) D的化学式为________。
(2)A、B、E中含有一种相同的元素,其名称为________。
(3)B和E反应可生成一种单质和一种常见的液态化合物,写出化学方程式________。
(4)写出C与氢氧化钾溶液反应的离子方程式___________。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。
为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c. NaOH d.HNO3
②以铝材为阳极,在过量的H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,原因是 ; (用离子方程式表示)。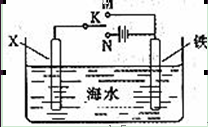
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是
(3)利用下面的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开光K置于M处,该电化学防护法称为 。
如图是8种有机化合物的转换关系:
请回答下列问题:
(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是______反应,③是______反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:________________________。
(4)C1的结构简式是______________;F1的结构简式是____________ ___。F1与F2的关系为________。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解
质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液的电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极的电极反应式为 、负极的电极反应式为 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的化学方程式为 ;若电解一段时间后,石墨棒上产生标准状况下的Cl2 224 mL,电解后的溶液总体积为200 mL,则溶液的pH =。
(3)若每个电池甲烷通入量为 1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F = 9.65×l04C· mol-1,列式计算),最多能产生的氯气体积为 L (标准状况)。