常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图。下列说法正确的是
| A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
固体乙醇晶体中不存在的作用力是
| A.极性键 | B.非极性键 | C.离子键 | D.氢键 |
以下分子或离子的结构为正四面体构型的是
①CH4②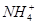 ③CH3Cl④P4⑤H2S
③CH3Cl④P4⑤H2S
| A.①②③ | B.①②④ | C.①②⑤ | D.①④⑤ |
下列化合物中,含有离子键和非极性共价键的是
| A.H2O2 | B.K2O2 | C.CaCl2 | D.FeCl2 |
下列粒子半径的比较中,正确的是
| A.Na+ >Na | B.Cl- >Cl | C.Ca2+ >Cl- | D.Mg >Na |
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
| A.N2H4+O2=N2+2H2O△H= —534.4kJ/mol |
| B.N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol |