体积均为100mL,浓度均为1mol·L-1的盐酸和硫酸溶液,分别加入质量相等的镁块充分反应,所生成的气体在相同条件下体积比为2:3,则镁块的质量为
| A.1.8 g | B.2.4g | C.3.6g | D.4.8g |
现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入Na2O2,得到沉淀的量与加入Na2O2的物质的量如图所示,原溶液中Cl-与SO42-的物质的量之比为 ()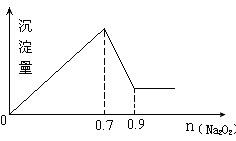
| A.1:3 | B.2:3 | C.6:1 | D.3:1 |
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是()
| a |
b |
c |
|
| A |
Al |
AlCl3 |
Al(OH)3 |
| B |
NO |
NO2 |
HNO3 |
| C |
Si |
SiO2 |
H2SiO3 |
| D |
S |
SO2 |
H2SO4 |
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是()
| A.NaHSO4和 Ba(OH)2 |
| B.MgCl2和 NH3·H2O |
| C.NaAlO2和 H2SO4 |
| D.AlCl3和 NaOH |
实验室里常见的如右图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是()

| A.NH4Cl受热分解的实验 |
| B.KMnO4受热分解的实验 |
| C.在一定温度,有催化剂存在条件下,SO2与O2生成SO3的可逆转变实验 |
| D.无水CuSO4与胆矾的互变实验 |
取一份矿石试样进行实验,首先将其溶于过量的盐酸,过滤后,向所得的沉淀X和溶液Y中分别加入NaOH溶液至过量(该矿石可看作由MgO、A12O3、SiO2、Fe2O3等矿物组成)。则下列叙述错误的是()
| A.溶液Y中加入过量的NaOH溶液后过滤,滤液和沉淀中各含两种金属元素 |
| B.该矿石成分中能溶于盐酸的都是碱性氧化物,不溶的是酸性氧化物 |
| C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ |
| D.沉淀X的成分是SiO2 |