【改编】[化学一选修5:有机化学基础)芳香族化合物水杨酸、冬青油、阿司匹林都是常用西药。它们的结构简式如下表:

(1)水杨酸分子中式量较大的含氧官能团名称是 。
(2)水杨酸在浓硫酸催化作用下与乙酸酐(CH3C0)20反应生成阿司匹林,反应的化学方程 。
(3)水杨酸在一定条件下可以聚合成高分子化合物聚水杨酸,聚水杨酸的结构简式为: 。
(4)写出冬青油的一种同分异构体结构简式:_____________________
异构体符合以下条件:
①芳香族化合物;
②苯环上一个氢原子被氯取代,有两种可能的产物;
③在足量氢氧化钠溶液中充分反应消耗等物质的量氢氧化钠。
(5)阿司匹林晶体中残留少量的水杨酸,可用______________(填试剂名称)检验.
实验室利用阿司匹林和水杨酸在乙酸乙酯中溶解度的差异,用结晶法提纯阿司匹林,请完成以下实验操作步骤:
①用少量热的乙酸乙酯溶解晶体.②________③经_____________操作得到纯净的阿司匹林晶体。
(6)效更佳的长效缓释阿司匹林( )在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
)在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
下表中有三组物质,每组都有一种物质与其他三种物质属于不同类别。请选出该种物质,并把该物质和选择依据(与其他物质不同之处)列在下表相应的空格内。
| 序号 |
物质 |
被选出的物质 |
选择依据 |
| 1 |
O2、H2、Cl2、N2 |
||
| 2 |
Fe、Na、Al、C |
||
| 3 |
NaOH、CO2、H2SO4、Fe2(SO4)3 |
请从上述三组物质(也可为该物质的水溶液)中按要求任意选取物质一步完成下列反应的化学方程式或离子方程式:
⑴生成酸性氧化物的化合反应(化学方程式)
⑵生成沉淀的复分解反应(化学方程式)
⑶可用来制取84消毒液的反应(离子方程式)
⑷同种元素之间发生的既是离子反应又是氧化还原反应(离子方程式)
(8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________σ键和________个π键。
(2)a与b的元素形成的10电子中性分子X的空间构型为________;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为________,其中X与
Ag+之间以________键结合。
(3)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因。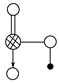
(4)氢键的形成对物质的性质具有一定的影响。 沸点。(填高或低)
沸点。(填高或低)
五种元素的原子电子层结构如下:
| A.1s22s1; |
| B.1s22s22p4; |
| C.1s22s22p6; |
| D.1s22s22p63s23p2 |
E.[Ar]3d104s1。
[用元素符号作答]
(1)元素的第一电离能最大的是 ;
(2)属于过渡元素的是 ;
(3)元素的电负性最大的是;
(4)上述元素之间能形成X2Y型化合物的化学式是 。
二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平)
Se+I2+KNO3+H2O(未配平)
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为。
A、B、C、D四种可溶性盐,知其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
②分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A B C D
(2)写出实验步骤②中涉及到的所有反应的离子方程式:
。