Ⅰ.(18分)Ⅰ.A、B、C、D、E、F是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
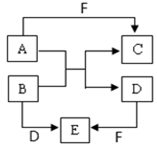
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去),则B+D→E的离子方程式为 ,C为同周期元素构成的1∶1型化合物,则C的电子式为 。
(2) 若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 ,A+B→C+D的化学方程式为 。
Ⅱ.甲、乙都是二元固体化合物,将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g;滤液中再滴加NaOH溶液,又出现蓝色沉淀。含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,经分析乙与红棕色固体的组成元素相同,向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g。
(1) 写出构成甲的阴离子的结构示意图 ;32g甲在足量浓硝酸中反应转移的电子数为 ;甲在足量氧气中充分灼烧的化学方程式为 。
(2)乙的化学式 ;稀硫酸溶解乙的化学方程式为 。
(3)将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为 ,设计实验证明此步反应后的溶液中金属元素的化合价 。
火箭推进剂由肼(N2H4)和液态过氧化氢组成,当它们混合反应时,即产生大量N2和H2O(g),并放出大量的热量。已知0.4mol液态肼与足量液态H2O2反应,生成N2和H2O(g)并放出256.65kJ热量。
(1)反应的热化学方程式为____________;
(2)反应中的氧化剂是_______;
(3)当放出256.65kJ热量时,转移电子数_______;
(4)此燃料的优点是____________________。
【化学-物物质结构与性质】原子序教依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界中存在多种A的化合物,B 原子核外电子有6 种不同的运动状态,B 与C可形成正四面体形分子.D 的基态原子的最外能层只有一个电子.其他能层均己充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素.其基态原子的价电子排布图为_________.第一电离能最小的元素是______(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是_________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为______、另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为______g•cm-3(保留两位有效数字).( )
)
(4)D元素形成的单质,其晶体的堆积模型为_________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是_______(填选项序号).
①极性键②非极性键③配位键④金属键
【化学― 化学与技术】煤炭被人们誉为黑色的金子,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放.人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率.煤的气化技术的主要产物是_________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为__________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:
上述过程中Fe2+的作用为__________。写出 的离子方程式______________。
的离子方程式______________。
②煤在燃烧时,进行脱硫处理,常采用_______燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_______设备,用石灰水淋洗。
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外.还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
请回答问题:
(1)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]_____c(NH4Cl)(填:<、= 或 >) 。
(2)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
(3)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要步骤:向沉淀中加入过量_______,充分反应后,过滤、洗涤、______。
(4)25℃,H3AsO4电离常数为K1=5.6×10-3、K2=1.7×10-7、K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是________。
② Na3AsO4第一步水解的平衡常数数值为:________。
③已知:AsO43-+2I-+2H+= AsO43-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+。上述两个反应中还原性最强的微粒是_______。
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
(1)滤渣1的主要成分为 。
(2)从滤液2中获得NiSO4.6H2O的实验操作 、 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用 。
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:
①A电极反应式为 和2H++2e- =H2↑。
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni g。