工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外.还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
请回答问题:
(1)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]_____c(NH4Cl)(填:<、= 或 >) 。
(2)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
(3)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要步骤:向沉淀中加入过量_______,充分反应后,过滤、洗涤、______。
(4)25℃,H3AsO4电离常数为K1=5.6×10-3、K2=1.7×10-7、K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是________。
② Na3AsO4第一步水解的平衡常数数值为:________。
③已知:AsO43-+2I-+2H+= AsO43-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+。上述两个反应中还原性最强的微粒是_______。
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和的洗气瓶。
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,
充分反应后,将液体和剩余气体分离,进行如下研究。
(1)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl- ,证明无色液体是SO2Cl2。
① 写出SO2Cl2与H2O反应的化学方程式。
② 检验该溶液中Cl-的方法是。
(2)继续研究反应进行的程度。用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
① 该白色沉淀的成分是。
② 写出SO2与Cl2反应的化学方程式,并阐述理由______。
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。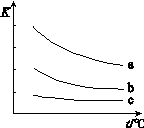
①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
(1)仪器A的名称为;A中反应的离子方程式为。
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 |
试剂 |
现象 |
| a |
紫色石蕊溶液 |
|
| b |
AgNO3溶液 |
出现白色沉淀 |
①实验a中的现象为。
②不能证明产生的气体中含有HCl的实验是(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol•L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol•L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol•L-1 AgNO3溶液的体积应大于mL(用含V的代数式表示)。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为。
(2)含乙酸钠和对氯酚(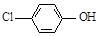 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
①B是电池的极(填“正”或“负”);②A极的电极反应式为。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
①阳极的电极反应式为。
②简述浓缩室中得到浓乳酸的原理:。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为L。(乳酸的摩尔质量为90 g• mol-1)
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II. 将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 mol•L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为 。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s) + C(s) ="==" MnO(s) + CO (g)△H = +24.4kJ • mol –1①
MnO2(s) + CO(g) ="==" MnO(s) + CO2(g)△H = -148.1 kJ • mol –1②
写出MnO2和C反应生成MnO和CO2的热化学方程式: 。
(3)H2O2分子中含有的化学键类型为 、 。
(4)III中MnO2溶解的离子方程式为 ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因: 。
(5)IV中,若改为“向0.50 mol•L-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因: 。
(6)V中MnCO3在空气中灼烧的化学方程式为 。