从实验测得不同物质中氧氧之间的键长和键能的数据:
| O—O键 数据 |
O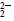 |
O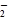 |
O2 |
O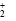 |
| 键长(10-12 m) |
149 |
128 |
121 |
112 |
| 键能(kJ·mol-1) |
x |
y |
z=494 |
w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是
A.成键的电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
在铁的电化学腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
| A.2H2O+O2+4e-===4OH- |
| B.2H++2e-===H2 |
| C.4OH--4e-===2H2O+O2 |
| D.Fe-2e-===Fe2+ |
已知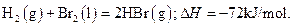 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
1mol分子中的化学键断裂 时需要吸收的能量/KJ 时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为( )
A.404 B.260 C.230D.200
下列说法或表示方法中正确的是()
| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
B.由C(石墨)→C(金刚石);ΔH="+1.9KJ/mol" , 可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8 KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.在稀溶液中:H+( aq )+OH-( aq)=H2O(l);ΔH="-57.3KJ/mol" ,若将0.5 mol浓H2SO4溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
有两只串联的电解池(Pt为电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液。电解时当甲池电极析出6.4gCu时,乙池电极析出21.6g 金属,则乙池的溶质可能是()
金属,则乙池的溶质可能是()
| A.NaNO3 | B.Cu(NO3)2 | C.Al(NO3)3 | D.AgNO3 |
下列描述中,不符合生产实际的是()
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |