已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的强 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述正确的是
A.容器①、②中反应达到平衡时所用的时间相等
B.平衡时,两个容器中NH3的体积分数均为12.5%
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.2 L,则平衡时放出的热量>23.15 kJ
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2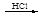 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v (Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v (Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 |
初始浓度 c/mol·L-1 |
溴颜色消失 所需时间 t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |

 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是 A. v (Br2)与c(CH3COCH3)成正比
A. v (Br2)与c(CH3COCH3)成正比
B.增大c(Br2),v (Br2)变小 C.增大c(HCl),v (Br2)增大
C.增大c(HCl),v (Br2)增大
D.实验②和③的v (Br2)相等
食品包装袋中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反映,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-==Fe3+ |
| C.脱氧过程中碳做原电池正极,电极反应为: O2+4 e-+4H+="=" 2H2O |
| D.含有2.24g铁粉的脱氧剂,理论上最多能吸收氧气672 mL(标准状况) |
已知:C(s)+O2(g)===CO2(g) ΔH1CO2(g)+C(s)==="2CO(g)" ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH34Fe(s)+3O2(g)===2Fe2O3(s)ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
| A.ΔH1>0, ΔH3<0 | B.ΔH2>0,ΔH4>0 |
| C.ΔH1=ΔH2+ΔH3 | D.ΔH3=ΔH4+ΔH5 |
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol ·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如下坐标曲线来表示: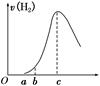
下列推论错误的是
| A.O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
| B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C.c点时反应处平衡状态 |
| D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |