应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①Be的氧化物的水化物可能具有两性
②第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体 ⑥H2Se是无色、有毒、比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径 :Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HmR |
| D.Y、Z形成的化合物中只可能存在离子键 |
已知:①H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)  kJ·mol-1,② C(s)+
kJ·mol-1,② C(s)+ O2(g)="CO(g)"
O2(g)="CO(g)"  kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)
kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) ,则
,则 为
为
| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.+352.3 kJ·mol-1 | D.-352.3 kJ·mol-1 |
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数;②原子总数;③分子总数;④物质的总能量;⑤物质的总质量
| A.①②⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
| 原电池 |
电解池 |
|
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3molPb |
生成2molAl2O3 |
| C |
正极:PbO2+4H++2e-=Pb2++2H2O |
阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D |
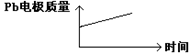 |
 |
下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是
| 选项 |
第Ⅰ栏 |
第Ⅱ栏 |
第Ⅲ栏 |
| A |
往少量NaOH溶液中投入铝片 |
往过量NaOH溶液中投入铝片 |
2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| B |
往Fe2(SO4)3溶液中滴入氢氧化钠溶液 |
往Fe2(SO4)3溶液中滴入氢氧化钡溶液 |
Fe3++3OH-=Fe(OH3)↓ |
| C |
往NaHCO3溶液中滴入Ca(OH)2溶液 |
往NaHCO3溶液中滴入NaOH溶液 |
OH-+HCO3-=CO32-+H2O |
| D |
往NaOH溶液中通入过量CO2气体 |
往NaOH溶液中通入少量CO2气体 |
CO2+OH-=HCO3- |