二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为 。
CH3OCH3(g)+ CO2(g)的热化学方程式为 。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
CH3OH (g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断ΔH 0 (填“ >”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是 。
A.体系的压强不变 B.密度不变
C.混合气体的相对分子质量不变 D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。请回答下列问题:
2NH3(g) ΔH=-92.4kJ•mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图。
已知用NaAlO2制备α—Al(OH)3及能量转化关系如图: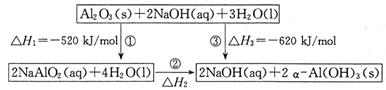
(1)反应②的热化学方程式为。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下: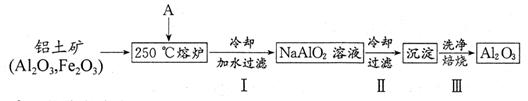
①物质A的化学式为;
②步骤Ⅲ的化学反应方程式为;检验步骤Ⅲ中沉淀是否洗净的方法是;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为。
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素。X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5。
(1)R元素在周期表中的位置;W2X2的电子式。
(2)X、Y、Z的最低价氢化物中:沸点最高的是(填化学式);共价键键能最小的是;X、Y、Z的杂化类型(填相同或不相同)。
(3)若R的晶体中每个晶胞平均含有2个R原子,请在下图晶胞中用•标出未画出的R原子。
(4)将1.19g ZXY2溶于100ml水中发生非氧化还原反应,生成2种酸,反应方程式为;所得溶液中阴离子浓度由大到小的顺序是。
铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
E.在潮湿的空气中放置不易生锈
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式:
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是
③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式:,
此法比直接用浓硫酸与铜反应有两个明显的优点:
。
(4)制备高纯硅的流程如下图:
写出石英砂制备粗硅的化学方程式:
。
某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 |
D.反应较快,产生无色气体 |
| ⑤将铝条投入稀盐酸中 |
E. 生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究同周期元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,
AlCl3溶液,NaOH溶液等。
仪器:,,烧杯,试管,试管夹,镊子,小刀,玻璃片等。
(3)实验内容:(完成实验步骤对应的实验现象的标号和离子方程式)
| 实验步骤 |
实验现象 |
离子方程式 |
| ① |
(不需填写) |
|
| ② |
||
| ③ |
||
| ④ |
C |
(不需填写) |
| ⑤ |
D |
|
| ⑥ |
(4)实验结论:从左向右,同周期元素原子的失电子能力递减,得电子能力递增。
已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。回答下列问题:
(1)元素D在周期表中的位置是。
(2)画出E的阴离子的结构示意图:。
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式:。
写出一种由A、C、D三种元素组成的共价化合物的化学式:。
(4)将9 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中,
完全吸收后,溶液中大量存在的阴离子是。