(16分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ∆H= kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)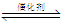 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H 0,(填“>”或“<”)。
若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)= 。[已知:Ksp(CaCO3)=2.8×10-9]
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象 ;当燃料电池消耗2.8 L O2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。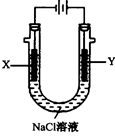
⑴近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是(填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用药品进行治疗(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C的结构简式是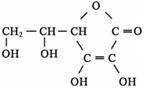 ,它的分子式是。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是,说明维生素C具有性。
,它的分子式是。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是,说明维生素C具有性。
⑵今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。某品牌高钙梳打的配料标签如图所示。在所列配料中,富含糖类的是,植物油在体内水解最终产物是高级脂肪酸和。碳酸氢钠、碳酸钙可调节人体内的过多的胃酸,写出碳酸钙与胃酸反应的离子方程式为。
③运载潜水钟的母船会产生大量废水和垃圾。科学实验的含汞离子废水 需要处理后再排放,可加入适量的硫化钠溶液,使汞离子变成(填化学式)沉淀而除去;
⑶著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能雕刻玻璃。制备普通玻璃的主要原料有SiO2、CaCO3、(填化学式)。
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为。
⑷材料的不断发展可以促进社会进步。
① “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中
使用了镁铝合金,选用镁铝合金的优点是(任答一点)。
②碳化硅硬度很大,它属于(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式;
写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在接触室中发生的反应的化学方程式_____________________________
(4)碳和浓硫酸反应的化学方程式__________________________________
已知物质A分子式为C3H4O2,显酸性。F为由七个原子组成的环状结构,分子式为C6H8O4。请根据以下框图回答问题:
(1)A的结构简式为________________________________。
(2)反应①的反应类型为__________________________。
(3)化合物B中含氧官能团的名称是______________________________。
(4)D和E生成F的化学方程式__________________________________。
D和E按照1:1反应也可生成高聚物,请写出生成该高聚物的化学反应方程式=______
________________________________________________________________________。
(5)G生成H的化学方程式________________________________________________。
(6)写出C的同分异构体中属于酯类物质的结构简式_______________________、
________________________、____________________________________(至少写3个)
按要求完成下列问题:
(1)某有机物的键线式是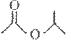 ,请写出它与NaOH溶液反应的化学方程式___________:
,请写出它与NaOH溶液反应的化学方程式___________:
(2)DDT人类合成的第一种有机氯农药,其分予结构球棍模型如图所示。请分析该物质的核磁共振'H谱图中有____________个吸收峰。
(3)F和 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
请回答下列问题:
①F的结构简式为____________
②C中所含官能团的名称为________。用____________仪可以测定D中所舍官能团。
③A→B的化学方程式为__________________________________________________。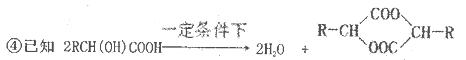
请参考题目中的合成途径,若合成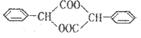 ,起始原料的某烃的结构简式
,起始原料的某烃的结构简式
为_________,最少用____________步反应,可以合成产物。
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。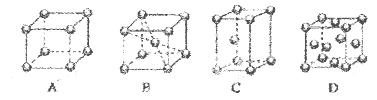
(1)M原子的外围电子排布式为_______________,在周期表中属于___________区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为____(填序号)。其空间利用率为____。
(3) MCl3•6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2•H2O和C、[M(H2O)4Cl2]Cl•2H2O
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.10molMCl3·6H2O 配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为___________(填A或B或C)。
(4)常温下为暗红色液体,熔点-96. 5℃,沸点117℃,能与丙酮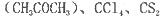 等互溶。
等互溶。
①固态MO2Cl2属于___________晶体;
②中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和_____杂化。
(5)+3价M的配合物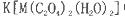 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。