【化学---化学与技术】工业上以黄铁矿为原料,采用接触法生产硫酸。
(1)在炉气制造中,生成SO2的化学方程式为__________________。
(2)炉气精制的作用是将含SO2的炉气_______________、_______________及干燥,如果炉气不经过精制,对SO2催化氧化的影响是 _________________。
(3)精制炉气(含SO2体积分数为7%、O2为ll%、N2为82%)中SO2平衡转化率与温度及压强关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是___________、___________。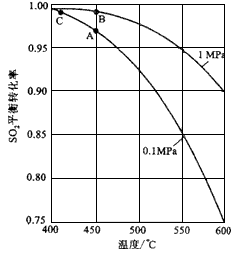
(4)在SO2催化氧化设备中设置热交换器的目的是_________、________,从而充分利用能源。
工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是______________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是___________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3B.KMnO4C.Cl2D.O2
除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3D.Na2CO3
锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下: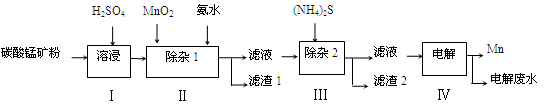
已知25℃,部分物质的溶度积常数如下:
| 物质 |
Mn(OH)2 |
Co(OH)2 |
Ni(OH)2 |
MnS |
CoS |
NiS |
| Ksp |
2.1×10-13 |
3.0×10-16 |
5.0×10-16 |
1.0×10-11 |
5.0×10-22 |
1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在(填“阴”或“阳”)极析出Mn,电极反应方程式为。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥mol·L-1。
用简短的文字和方程式解答下列问题:
(1)Na2CO3溶液可做洗涤剂去除油污,而且热的溶液去污效果更好。其原因是。
(2)实验室有两瓶失去标签且pH=3的溶液,已知它们是稀盐酸和醋酸,请写出区别它们的一种方法:。
研究表面,可用NaBH4与水反应制氢氧燃料电池的氢气:BH4-+2H2O=BO2-+4H2↑(实质为水电离产生的H+被还原)。下表为pH和温度对本反应中NaBH4半衰期的影响(半衰期是指反应过程中,NaBH4的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH |
不同温度下NaBH4的半衰期(min) |
|||
| 0℃ |
25℃ |
50℃ |
75℃ |
|
| 8 |
4. 32 ×100 |
6. 19 ×10-1 |
8. 64 ×10-2 |
1.22 ×10-2 |
| 10 |
4. 32 ×102 |
6. 19 ×101 |
8. 64 ×100 |
1.22 ×100 |
| 12 |
4. 32 ×104 |
6. 19 ×103 |
8. 64 ×102 |
1.22 ×102 |
| 14 |
4. 32 ×106 |
6. 19 ×105 |
8. 64 ×104 |
1.22 ×104 |
根据要求回答下列问题:
(1)NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为___________。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
答:。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
答:。
(4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应)。其可能原因是。
A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;
________________和________________。(与第一组的物质类别不同)
(2)A、B应满足的条件是_____________________________________________。