(9分)
(1)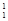 H、
H、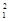 H、
H、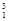 H互为________,16O2、18O3互为________。
H互为________,16O2、18O3互为________。
| A.同位素 | B.相同物质 |
| C.同素异形体 | D.同分异构体 |
(2)某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的相对原子量约为________,R元素周期表中的位置为________________。
(3)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(4)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。
硫铁矿高温下被空气氧化产生二氧化硫:4FeS2+11O2 8SO2+2Fe2O3
8SO2+2Fe2O3
设空气中O2和N2的体积分数分别为20%和80%。试完成下列各题:
(1)1 mol FeS2完全氧化,理论上(不考虑各种气体损失,以下同)需要空气体积(标准状况)为L。
(2)55 L空气(标准状况)和足量FeS2完全反应后,气体体积变为(标准状况)L。
(3)在工业生产H2SO4中,为提高SO2的转化率,进入接触室的SO2和O2的体积比往往为1∶1,那么在工业生产中氧化1mol FeS2最少需空气的体积(标准状况)为___________L。进入接触室的混合气体中SO2的体积分数为____________。
(15分)填写下列空白:
(1)Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫______________。
(2)强光通过Fe(OH)3胶体,可看到光带,这种现象叫________________。
(3)淀粉与食盐的混合液放在肠衣(半透膜)中,并把它悬挂在盛有蒸馏水的烧瓶里,从而使淀粉与食盐分离,这种方法_______________。
(4)Fe(OH)3胶体加硅酸胶体,胶体变得浑浊,这是发生了____________。
(5)已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中_____%的氢键
(8分) 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mold.无法确定
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_____周期、第_____族;
(2)写出反应①的化学方程式______________________________________________;
(3)写出反应④的离子方程式______________________________________________;
(4)写出反应③的电极方程式:
阳极:_______________________阴极:___________________________
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称),以下三种说法中,可以验证该结论的是(填写编号);
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
(3)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。