[化学---选修3:物质结构与性质] (15分)太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 。(用元素符号表示)
(3)SeO3分子的立体构型为 。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。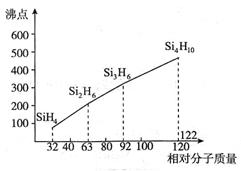
(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
粗铜中常含有锌、镍、银、金等杂质,工业上常用电解的方法精炼粗铜。
(1)电解时__________作阳极,电极反应式为_______________________;作阴极,电极反应式为_________________________。
(2)电解前CuSO4溶液的浓度为1 mol·L-1,电解时如有0.5 mol电子发生转移,则此时电解液中CuSO4的浓度为,阴极得到的纯铜质量为。阳极泥的主要成分是__________________。
将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝件表面形成氢氧化铝薄膜的电极反应式为____________________。
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是__________________________
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离子方程式为____________________。
塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
①______________________________________;②___________________________________。
(2)设通过268 mA的电流60 min后,阴极上沉积出铜0.2879 g,阴极上还可能放出的气体是;该气体在标准状况下的体积是。
请判断下图所示的装置中,A、B、C各是什么池。
A_____________________________________;
B_____________________________________;
C_____________________________________。
以A、B两根石墨棒作电极,电解AgNO3溶液,通电t min,在B极收集到气体11.2 mL(标准状况),然后将电源反接,以相同的电流通电t/2 min,若溶液体积为200 mL(设体积不变),则溶液的pH为。