(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)  H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)  H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)  H= 。(请用含有
H= 。(请用含有 H1、
H1、 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为 g(假设溶液电解前后体积不变)。
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验
室里从海洋中提取碘的流程如下:
⑴指出提取的过程中有关实验操作名称:①;③;
⑵提取碘的过程中,可供选择的溶剂是__________。
| A.酒精 | B.四氯化碳 | C.乙酸 | D.苯(E)水 |
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏。指出下图所示实验装置中的错误之处;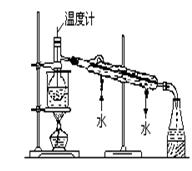
① ; ②;③。
(4)进行上述蒸馏操作时,使用水浴的原因是;最后碘晶在里聚集。
含有下列离子的五种溶液①Ag+ ②Mg2+ ③Al3+ ④ Fe2+ ⑤Fe3+ 试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向④中加入NaOH溶液,现象是有关化学方程式为
、。
(3)加入过量NaOH溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1) 在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。原子结构示意图为________________ 。元素⑩名称为单质与水反应化学方程式。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合
物的电子式是:_____________。
(3) ②的最高价氧化物的化学式为写出其最高价氧化物的水化物与足量的铁粉反应的离子方程式_____________________________________________。
(4) 用电子式表示元素④与⑥的化合物的形成过程:,
该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦、①与⑥形成的化合物的电子式、。
(6)③、⑥氢化物的沸点高低;原因
(7)④、⑥、⑦形成的简单离子的半径大小
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%。该化合物的化学式为_________________。
(9)④和③两种元素形成含有非极性键的化合物化学式为______,鉴别该化合物中含④元素常用方法;利用该化合物制取③单质的化学方程式。
已知A、B、C、D、E属于原子序数依次增大的短周期主族元素。短周期元素中C元素的原子半径最大,A的原子半径最小。B元素能形成一种碱性气体。E元素原子的最外层电子数是次外层电子数的一半,且在周期表中与D元素相邻。
(1)写出3种元素的名称:C________ 、D_________、 E___________。
(2)写出D元素在周期表中的位置:__________________________。
(3)画出C元素原子的结构示意图:____________________。
(4)写出D、E的氧化物分别与强碱溶液反应的离子方程式:
___________________________________________;
___________________________________________。
(5)A、B两元素能形成一种5核10电子的阳离子,请叙述实验室检验溶液中的该离子的操作方法:___________________________________________
____________________________________________________。
Q、R、X、Y、Z 为前 18 号元素中的五种,Q 的低价氧化物与 X 单质分子的电子总数相等,R 与 Q 同族,X、Y与Z不同族,Y 和 Z 的阴离子与 Ar 原子的电子结构相同且 Y 的原子序数小于 Z。
(1)Q 的最高价氧化物,其固态俗名叫____________;
(2)R 的氢化物分子的空间构型是_____________,它与 X 形成的化合物可作为一种重要的陶瓷材料,其化学式是_____________;
(3)X 的常见氢化物的空间构型是_____________;它的另一氢化物 X2H4是一种火箭燃料的成分,其电子式是___________________;
(4)Q 分别与 Y、Z 形成的化合物的化学式是_____________和____________;Q和 Z 形成的化合物分子的结构式是_____________________,属于____________化合物(填“离子”或“共价”)。