甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= 。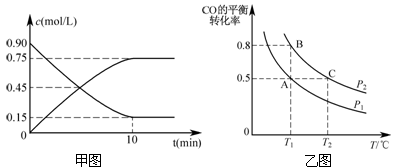
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
写出有关的元素符号或名称
(1)某元素最外层电子数是次外层电子数的2倍,该元素符号是。
(2)某元素K层与M层电子数相同,该元素名称是。
写出下列反应化学方程式:
⑴二氧化氮和水反应:;
⑵碳和浓硝酸共热:;
⑶铜和稀硝酸反应:;
某同学设计了一种电解法制取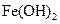 的实验装置(如
的实验装置(如 图)。玻璃管内的电解液为
图)。玻璃管内的电解液为 溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
(1)写出A电极的电极反应式_________;B电极的电极反应式__________;
(2)若电解改用 溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用
溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用 溶液作电解液时白色沉淀能保持较长时间的原因_____________。
溶液作电解液时白色沉淀能保持较长时间的原因_____________。
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的_____极,发生的电极反应为_________;
X电极上发生的电极反应为_____________________;
(3)外电路中的电子是从_______电极流向________电极。(填电极材料名称)
(1 )在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为:。
)在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为:。
(2)用离子方程式表示下列化学变化:
①电解氯化钠溶液__________________________________ __
__
②电解硝酸银溶液_____________________________________