将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4·5H2O)。
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在 左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是 。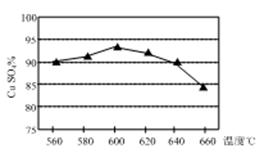
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。
①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm—3)的H2O2来配制,其具体配制方法是 。
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步: 。
第三步: ,过滤。
第四步: 、冷却结晶。
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为 。
G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)写出G中含氧官能团的名称
(2)B→C的反应类型是。
(3)E的结构简式是
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
(5)某芳香化合物是G的同分异构体,写出同时符合下列条件的该同分异构体的结构简式 (写一种)
①遇氯化铁溶液显紫色 ②能发生银镜反应和水解反应 ③有四种不同化学环境的氢原子
(6)已知(1) (2)苯酚具有还原性,易被硝酸等氧化剂氧化
(2)苯酚具有还原性,易被硝酸等氧化剂氧化
根据已有知识并结合流程中相关信息,写出以苯酚和乙醇为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br  CH2=CH2
CH2=CH2
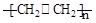
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)在①~⑨元素中,金属性最强的元素是,氧化物有两性的
元素是。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)______________________________________
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为 _____________________________________________________
(4)③的氢化物的电子式为__________________
(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有
( 8 分)有机物A的结构简式为  ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.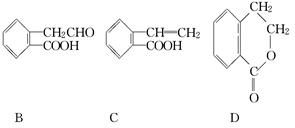
(1)B中含氧官能团的名称是________.
(2)A―→C的反应类型是________;A~D中互为同分异构体的是________.
(3)由A生成B的化学方程式是______________________________________.
【选修3-物质的结构与性质】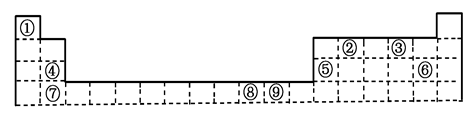
上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。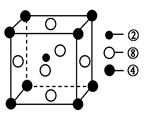
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。
(1)25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是(用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是。
①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图: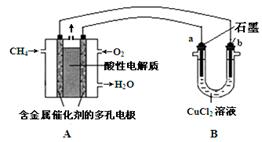
请回答:
① 甲烷燃料电池的负极反应式是。
② 当线路中有0.2 mol电子通过时,阴极增重____g。