设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.常温常压下,2.24 L H2O中含有极性共价键的数目为0.2 NA |
| B.0.1 mol·L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA |
| C.100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA |
| D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
下列事实与胶体知识有关的是
①用盐卤点豆腐;②生产出果冻;③用明矾净水;④河海交汇处可沉积成沙洲;⑤初冬凌晨的迷雾的形成
| A.①②③ | B.②③④ | C.①③⑤ | D.全部都是 |
下列各组混合物能用分液漏斗直接分离的是
| A.柴油与汽油 | B.汽油与水 | C.溴与水 | D.水与乙醇 |
下列反应中,反应前后元素的化合价没有变化的是
A.CO2+C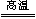 2CO 2CO |
B.SO2+H2O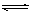 H2SO3 H2SO3 |
| C.2NaOH+Cl2====NaCl+NaClO+H2O | D.2CO+O2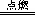 2CO2 2CO2 |
在标准状况下,下列气体含有的分子数最多的是
| A.36.5g HCl | B.22.4L O2 | C.4g H2 | D.0.5mol SO2 |
对于电解质的导电能力,下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.导电能力强的溶液一定是浓溶液 |
| C.相同温度下,导电能力强的溶液中离子个数一定多 |
| D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强 |