在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g)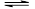 2C(g)+D(s) △H=a kJ·mol-1
2C(g)+D(s) △H=a kJ·mol-1
实验内容和结果分别如下表和下图所示。下列说法正确的是
| 实验 序号 |
温度 |
起始物质的量 |
热量 变化 |
|
| A |
B |
|||
| Ⅰ |
600℃ |
1 mol |
3 mol |
96 kJ |
| Ⅱ |
800℃ |
1.5 mol |
0.5 mol |
—— |
A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.上述方程式中a=-160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
| t/s |
0 |
5 |
15 |
25 |
35 |
| n(A)/mol |
1.0 |
0.85 |
0.81 |
0.80 |
0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是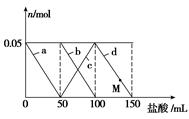
A.a曲线表示的离子方程式为: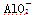 +H++H2O===Al(OH)3↓ +H++H2O===Al(OH)3↓ |
| B.b和c曲线表示的离子反应是相同的 |
C.原混合溶液中的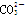 与 与 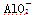 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| D.M点时,溶液中沉淀的质量为3.9 g |
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应4 min时,若HCl浓度为0.12 mol·L-1,则H2反应速率为0.03 mol·L-1·min-1 |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应 |
常温下,下列各组离子在指定溶液中能大量共存的是
A.使酚酞试液变红的溶液中:S2-、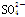 、 、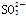 、Na+ 、Na+ |
B.由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、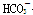 、 、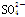 、K+ 、K+ |
C.pH=0的溶液中:Na+、K+、Fe2+、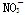 |
D.pH=7的溶液中:Al3+、Cl-、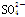 、 、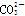 |
下列有关溶液的说法正确的是
| A.向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,混合液的pH=7 |
| B.实验测定,NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 |
| C.NH4Cl溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH-) |
| D.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |