硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
(1)①5分钟时O2的反应速率是_________;
②列式并计算该条件下反应的平衡常数K=___________。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率_______(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____________。(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___________K(B)(填“>”、“<”或“=”)。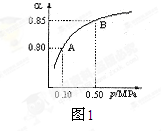
(3)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
揖选做题铱本题包括
、
两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按
小题评分。
A.一项科学研究成果表明,铜锰氧化物(
)能在常温下催化氧化空气中的一氧化碳和甲醛(
)。
(1)向一定物质的量浓度的
和
溶液中加入
溶液,所得沉淀经高温灼烧,可制得
。
①
基态的电子排布式可表示为。
②
的空间构型是(用文字描述)。
(2)在铜锰氧化物的催化下,
被氧化为
,
被氧化为
和
。
①根据等电子体原理,
分子的结构式为。
②
分子中O 原子轨道的杂化类型为。
③1
中含有的σ键数目为。
(3) 向
溶液中加入过量
溶液可生成
。不考虑空间构型,
的结构可用示意图表示为。
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
①反应
的
=kJ·mol-1(用含
、
的代数式表示)。
②
是反应过程中的中间产物。
与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为。
(2)镁铝合金(
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
、
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
。得到的混合物
(
)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(
)时通入氩气的目的是。
②在
溶液中,混合物
能完全释放出
。1 mol
完全吸氢后得到的混合物
与上述盐酸完全反应,释放出
的物质的量为。
③在
和
溶液中,如图混合物
均只能部分放出氢气,反应后残留固体物质的
射线衍射谱图如图所示(
射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述
溶液中,混合物
中产生氢气的主要物质是(填化学式)。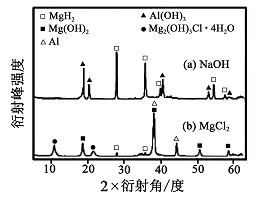
(3)铝电池性能优越,
电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为。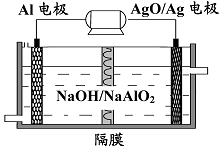
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(
、
总含量约为99%)回收
并制备
的部分实验过程如下:
(1)①铜帽溶解时加入
的目的是(用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的
除去。除去
的简便方法是。
(2)为确定加入锌灰(主要成分为
、
,杂质为铁及其氧化物)的量,实验中需测定除去
后溶液中
的含量。实验操作为:准确量取一定体积的含有
的溶液于带塞锥形瓶中,加适量水稀释,调节溶液
=3~4,加入过量的
,用
标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇
(白色)↓
①滴定选用的指示剂为,滴定终点观察到的现象为。
②若滴定前溶液中的
没有除尽,所测定的
含量将会(填"偏高"、"偏低"或"不变")。
(3)已知
>11 时
能溶于NaOH溶液生成
。下表列出了几种离子生成氢氧化物沉淀的
(开始沉淀的
按金属离子浓度为1. 0
计算)。
| 开始沉淀的 | 沉淀完全的 | |
| 1. 1 |
3. 2 |
|
| 5. 8 |
8. 8 |
|
| 5. 9 |
8. 9 |
实验中可选用的试剂:30% 、1. 0 、1. 0 。由除去铜的滤液制备 的实验步骤依次为:①;②;③过滤;④;⑤过滤、洗涤、干燥;⑥900℃煅烧。
(12 分)硫酸钠-过氧化氢加合物( )的组成可通过下列实验测定:①准确称取1. 7700 样品,配制成100. 00 溶液A。②准确量取25. 00 溶液 ,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 5825 。③准确量取25. 00 溶液 ,加适量稀硫酸酸化后,用0. 02000 溶液滴定至终点,消耗 溶液25. 00 mL。 与 反应的离子方程式如下:
(1)已知室温下
的
=1.1×10-10,欲使溶液中
≤1.0×10-6
1,应保持溶液中
≤1. 0×10-6
,应保持溶液中
≥
。
(2)上述滴定若不加稀硫酸酸化,
被还原为
,其离子方程式为。
(3)通过计算确定样品的组成(写出计算过程)。
合成氨的流程示意图如下: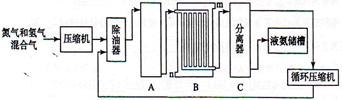
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式,;
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是,其中发生的化学反应方程式为;
(3)设备B的名称是,其中m和n是两个通水口,入水口是(填"m"或"n")。不宜从相反方向通水的原因是;
(4)设备C的作用是;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过以下反应来实现:
已知1000K时该反应的平衡常数 ,若要使 的转化率超过90%,则起始物中的 不低于。