(15分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)==2Fe(s)+3CO(g) △H1=+489.0kJ•mol-1,C(s)+CO2(g)==2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液),写出该电池的负极反应式: 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
1mol CO2、3mol H2 |
a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是 。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式 。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是。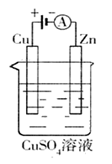
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是;
正极的电极反应式是。
(3)下图是一个电化学过程示意图。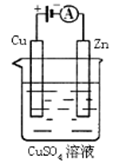
①锌片上发生的电极反应是。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是。
某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A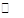 H++HA-,HA-
H++HA-,HA-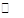 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是;
(2)c(H2A)最大的是,最小的是;
(3)c(A2-)最大的是,最小的是。
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
根据两反应本质, 判断能否设计成原电池:A、_________,B、__________
(选择“能”或“不能”);
(2)如果不能,说明其原因_______________________________________________;
(3)如果可以, 则写出正、负极材料及其电极反应式,电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
(11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
(1)80~90ml对应反应的离子方程式。
(2)金属铝的质量为_______
(3)盐酸的体积是ml。
(4)a的取值范围是_____。
(5)n(Mg)/n(Al)的最大值是 。
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为_________。该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是_______。
(2)除去镁粉中混有的铝粉(用离子方程式表示)。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是(用化学方程式表式)
(4)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。则放出H2的体积为升(标况下)
(5)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式