(15分)三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3•5H2O]的实验流程如图所示:

①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3•5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器 (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3•5H2O含量偏低的是 。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3•5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤; ;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3•6H2O; ,得到无水FeCl3。
某校化学课外活动小组利用下面所提供的仪器装置和药品制取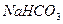 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀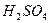 ④饱和
④饱和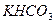 溶液 ⑤浓
溶液 ⑤浓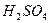 ⑥
⑥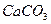 固体 ⑦
固体 ⑦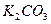 粉末仪器装置(如下图所示):
粉末仪器装置(如下图所示):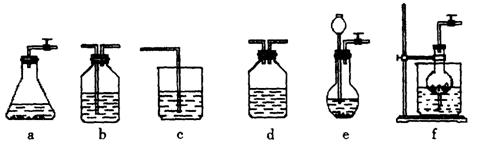
请根据题目要求回答下列问题:
(1)请按下表要求,填写选择的装置和药品。
(2)如何检验所选择的 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
______________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量 后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
附:有关物质在常温(20℃)时的溶解度
| 化学式 |
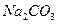 |
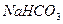 |
NaOH |
NaCl |
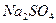 |
溶解度(g/100g ) ) |
21.3 |
9.60 |
107 |
35.8 |
19.4 |
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置: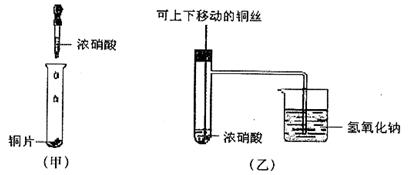

(1)写出铜和浓硝酸反应的化学方程式______________________________________。
(2)和甲装置相比,乙装置的优点__________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹_______,再打开弹簧夹______________,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作____________________________________________________。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_________________________(气体按标准状况计算)。
(本题12分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下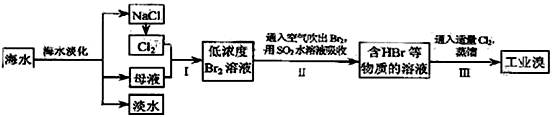
(1)请列举海水淡化的两种方法: 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除保护环境外,在工业生产中应解决的主要问题是 。
(4)某化学研究性学习小组为了解从工业生产中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能使用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④ C中液体颜色为 。为除去产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有中的一种或两种。
【实验探究】
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
||
| 步骤②: |
含有Fe3+ |
||
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
含有两种气体 |

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
。
为了证明CO具有还原性,有人设计了如图所示的实验.
(1)装置B的最适宜的试剂是.
(2)装置D中发生反应的化学方程式是.
(3)必须用装置C吸收除去气体中水蒸气的理由是.
(4)若根据F中石灰水变浑浊的现象也能确认CO具有还原性,应在下图中装置与之间连下图所示的装置(填序号).