(本题12分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下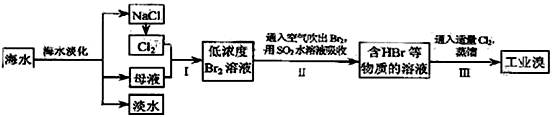
(1)请列举海水淡化的两种方法: 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除保护环境外,在工业生产中应解决的主要问题是 。
(4)某化学研究性学习小组为了解从工业生产中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能使用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④ C中液体颜色为 。为除去产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4·5H2O)。
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是。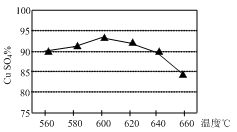
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。
①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm—3)的H2O2来配制,其具体配制方法是。
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步:。
第三步:,过滤。
第四步:、冷却结晶。
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为。
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。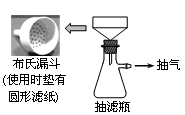
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是。抽滤所用的滤纸应略(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是,滴定终点溶液的颜色呈色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是。
(4)1kg卷心菜中所含维生素C相当于片上述维生素药片。(用含V1、V2的代数式表示)
硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:
(1)写出反应Ⅰ的离子方程式:(任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是,可采取的措施为。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是。
(5)若用下图所示实验装置制取Al(NO3)3,通入水蒸气的作用是。
实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下: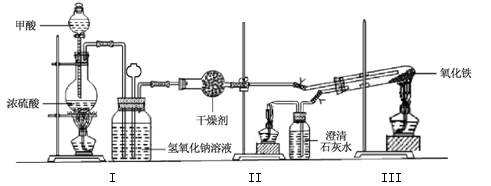
|
|
①按上图连接好装置,检查装置气密性。
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。| 加热方式 |
产物元素组成 |
各元素的质量分数% |
|
| Fe |
O |
||
| 酒精灯 |
Fe和O |
74.50 |
25.50 |
| 带网罩酒精灯 |
Fe和O |
76.48 |
23.52 |
| 酒精喷灯 |
Fe |
100.00 |
0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____:1。(要求保留整数)
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
请回答下列问题:
(1)铁在元素周期表中的位置为。
(2)写出TiO2+水解的离子方程式:。
加入过量铁粉的作用是:①;②。
(3)操作I的实验步骤为:___________________,过滤。
(4)副产品主要成分的化学式为。
(5)写出TiO2转化成TiCl4的化学方程式。