配制480mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________等。
(2)计算、称量:需称量NaOH固体的质量为__________________。
(3)溶解、冷却,该步实验中需要使用玻璃棒,作用是___________________。
(4)转移、洗涤。洗涤烧杯2~3次是为了______________________________。
(5)定容、摇匀。定容的具体操作是____________________________________。
(6)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,偏低的是 (填字母序号)
| A.容量瓶洗净后未烘干; |
| B.在溶解过程中有少量液体溅出烧杯外 |
| C.定容时俯视刻度线; |
| D.将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 |
E.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有。
(2)硫酸铜溶液可以加快氢气生成速率的原因是。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合液 |
A |
B |
C |
D |
E |
F |
| 4mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=。
②反应一段时间后,实验E中的金属呈色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因。
(12分)中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(可能用到的相对原子质量:H—1 O—16 S—32) (1)仪器B的名称是,水通入A的进口为。
(1)仪器B的名称是,水通入A的进口为。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,写出该反应的离子方程式:。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为;若滴定的实验操作如下:
①检查滴定管是否漏水
②用标准液润洗盛标准液的滴定管
③装标准溶液并调整液面(记录初读数)
④用蒸馏水洗涤玻璃仪器
⑤把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇至滴定终点,记下滴定管液面刻度。
则滴定操作的正确顺序是(用序号填写)____________________________;
(4)用标准NaOH溶液滴定时,以下操作引起误差偏大的是。
| A.滴定前仰视,滴定后俯视 |
| B.盛标准液的滴定管用蒸馏水洗后未用标准液润洗 |
| C.颜色改变立即读数 |
| D.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡 |
(5)滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量为g·L-1
(10分)(1)下图所示是中学化学常用的玻璃仪器,请在下列操作中填入相应的仪器
①从氯化钠溶液中获得氯化钠晶体______。
②分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物______。
(2)实验室需用230ml 1.0mol/L的NaOH溶液
①在配制溶液过程中,上述仪器中还缺少的玻璃仪器是:________________玻璃捧等。
②计算需称量的NaOH固体质量为________________g
③配制过程中,下列操作情况会使结果偏低的是
| A.溶解后未冷却直接转移至容量瓶,立即定容 |
| B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,继续加水定容 |
(3)若1.0mol/LNaOH溶液的密度为1.1g/cm3,则质量分数为__________%
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸②乙醇③苯酚④乙酸
I.甲同学设计并实施了如下实验方案。
| 编号 |
实验操作 |
实验现象 |
结论及解释 |
1 |
分别取4种溶液,滴加紫色石蕊溶液 |
溶液变红的是①④溶液 |
略 |
2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 |
②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: ________________________ |
3 |
用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) |
_______________ |
略 |
4 |
将CO2通入C6H5ONa溶液中 |
_______________ |
反应的化学方程式: _______________________ |
| 结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 |
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。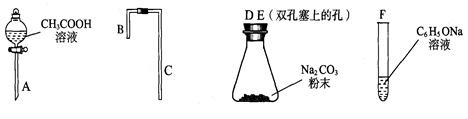
(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)______中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_______溶液的洗气装置,使乙同学的实验设计更加完善。
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。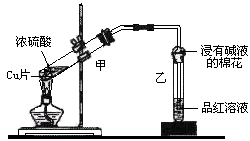
请回答下列问题:
(1)通过试管乙中发生的现象说明了铜和浓硫酸发生了化学反应。
(2)试管乙口部浸有碱液的棉花的作用是,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)、(填“有”或“无”)毒气体。
(3)写出试管甲中所发生反应的化学反应方程式。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水1 L,加入0.5 mol ·L—1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:该1 L雨水中共溶解的SO2体积是mL(标准状况)。