50 mL 0.50 mol・L-1盐酸与50 mL 0.55 mol・L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
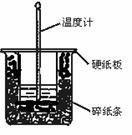
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验改用60 mL 0.50 mol・L-1盐酸跟50 mL 0.55 mol・L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol・L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图: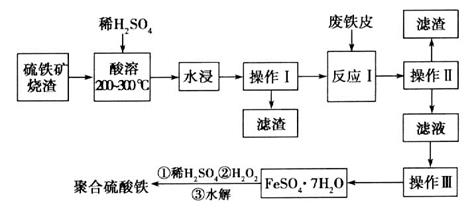
(1)实验室实现“操作I”所用的玻璃仪器有_______、________和烧杯。
(2)检验“酸溶”后的溶液中含有Fe2+试剂是_______,现象是_______。
(3)“操作III”系列操作名称依次为______、______、过滤和洗涤。洗涤的方法是______________。
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:__________________。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为。
(2)B中所装试剂是,E中冷水的作用是F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式。
(2)浓硫酸的作用是:①;②。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是。
(5)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是,该过程中发生反应的化学方程式是。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: ___________。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:____________。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有______种氢原子。 |
| (5)综上所述,A的结构简式。 |
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: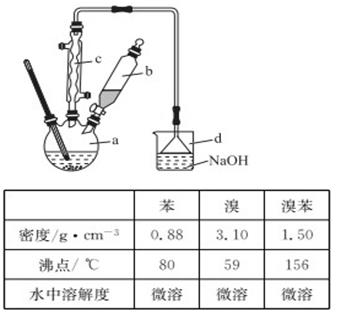
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体,继续滴加液溴滴完。装置d的作用是______________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________;
③向分出的粗苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A.25 mL B.50 mLC.250 mLD.500 mL