【化学-物质结构与性质】(13分)X、Y、Z、W、Q五种元素的原子序数依次增大,已知X原子核外电子占3个不同能级,且每个能级上排布的电子数相同,Z原子L电子层上有2对成对电子,W元素的最高正价与最低负价的代数和为6,Q的+1价阳离子核外有3个电子层均处于全满状态。回答下列问题:
(1)X的基态原子最外层有____种不同运动状态的电子,Q+的基态核外电子排布式为_______;
(2)X、Y、Z三种元素的第一电离能由小到大的顺序为______(填元素符号),形成的最简单氢化物的熔点由低到高的顺序是_______(填化学式);
(3)YW3中心原子的杂化方式为________,其分子空间构型为________;
(4)X、Z两种元素形成的化合物XZ2分子中含有_____个σ键和______个π键;
(5)用晶体的x射线衍射法对Q的测定得到以下结果:Q的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为____;Q的原子半径是_____(阿伏加德罗常数为NA)。
酯类有机物E(C6H8O4)广泛用于涂料行业中,其合成路线如下(其中直链烃A的分子式为C4H8,核磁共振氢谱中有两种等效氢,没有支链;B的相对分子质量比A大69)。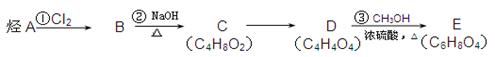
信息提示:①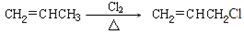
②R-CH2OH 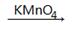 R-COOH
R-COOH
(1)烃A的结构简式为________________,D中官能团名称______________;
(2下列说法正确的是___________(填序号)。
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C能使溴水褪色
(3)C转化为D经过4步反应完成: ,则步骤④所需的无机试剂是___________;
,则步骤④所需的无机试剂是___________;
步骤⑤的反应类型是_________________。(填“氧化”或“还原”)反应
步骤④⑥的设计目的是。
已知F为高分子化合物: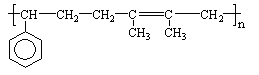
C分子结构中只含有一种氢。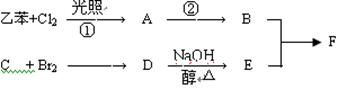
(1)写出下列物质结构简式
B:C:E:
(2)判断①②反应类型:、
(3)写出D→E的化学方程式
(1)请根据官能团的不同对下列有机物进行分类:
①(CH3)3CCH2OH②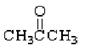 ③
③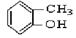
④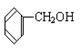 ⑤
⑤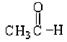 ⑥
⑥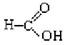
上述物质中,属于芳香醇的是,属于酚类的是
属于羧酸类的是,属于醛类的是(填序号)
(2)下列属于同系物的是,属于同分异构体的是(填入编号)
(10分)二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:
步骤①:称取a g I2,(加少量KI助溶),配成1L 5×10-3mol·L-1溶液;
步骤②:取步骤①中溶液10mL,稀释至100mL;
步骤③:量取步骤②中溶液5.00mL于试管2中,加入2~3滴淀粉溶液;
步骤④:如图抽气N次至溶液蓝色刚好褪去。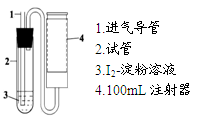
(1)步骤①中配制1L溶液时,除用到天平、药匙、烧杯、量筒、玻璃棒、胶头滴管外,还用到的玻璃仪器有;需称量单质碘的质量a为(保留小数点后两位)。
(2)SO2与碘水反应的离子方程式为。
(3)实验时,注射器每次缓缓抽气100mL。
①若抽气太快,将导致结果(选填:“偏大”、“偏小”、“不变”)。
②若某次实验时抽气共80次,试计算该地空气中SO2的含量(mg/L) (写出计算过程)。
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。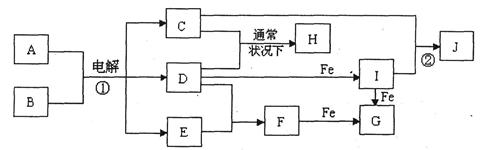
(1)H的化学式为。
(2)F的电子式为。
(3)反应①的化学方程式为。
(4)反应②的离子方程式为。