一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国。ACV是一种由苹果发酵而成的酸性饮品,是具有明显药效的健康食品,解毒、降脂、减肥和止泻功能。苹果酸是这种饮料的主要酸性物质,分离提纯后的化学分析如下:
①元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24∶3∶40;该酸蒸气的密度是同温同压下氢气的67倍。②0.1 mol该酸与足量NaHCO3反应放出4.48 L CO2,与足量金属钠反应放出3.36 L H2(气体体积均为标准状况下测定)。请完成下列问题:
(1)该酸的分子式为______________,结构简式为___________________。
(2)写出该酸在Cu/Ag催化剂条件下,被氧气氧化的化学反应方程式:___________________。
(3)写出该酸在一定条件下,每两个分子发生分子间脱水生成环酯的所有结构简式_______
_________。
锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下: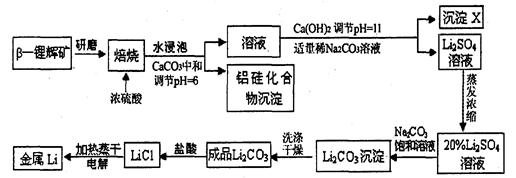
(1)用氧化物形式表示LiAlSi2O6的组成:________▲___________。
(2)沉淀X的主要成分是(写化学式)________ ▲________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:_____ ▲___________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:▲______________。
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是______▲_______________。
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H 2O 2氧化为Cr(Ⅵ)。制三氯化铬的流程如下: 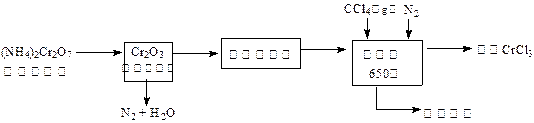
(1)重铬酸铵分解产生的三氧化二铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ▲ ,如何用简单方法判断其已洗涤干净 ▲。
(2)已知CCl 4沸点为57.6℃,为保证稳定的CCl 4气流,适宜的加热方式是 ▲。
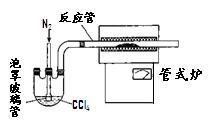
(3)用右图装置制备CrCl 3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl 4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在50~60℃之间;④反应管出口端出现了CrCl 3升华物时,切断加热管式炉的电源;⑤停止加热CCl 4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→
▲。 
(4)已知反应管中发生的主要反应有:Cr 2O 3+ 3CCl 4→ 2CrCl 3+ 3COCl 2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 ▲。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O 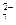 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr 2O 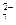 +6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
+6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
①该实验可选用的指示剂名称为 ▲ 。
②移入碘量瓶的CrCl 3溶液需加热煮沸,加入Na 2O 2后也要加热煮沸,其主要原因是 ▲。
③样品中无水三氯化铬的质量分数为 ▲ 。
下图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体,据此填写下列内容: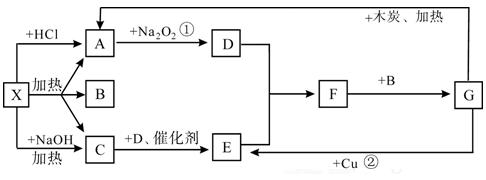
(1)写出有关物质的化学式:X: ,C: ,E: , F: 。
(2)写出反应①的化学方程式:________________________________________ ,
(3)写出反应②的化学方程式:________________________________________ ,
(4)写出反应C→E的化学方程式:_____________________________________ ,
(5) 写出反应×→C的
写出反应×→C的 化学方程式:____________________________________。
化学方程式:____________________________________。
A、B、C、D、E分别为(NH4)2SO4、NH4Cl、NaCl、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合:
(1)A和B混合产生白色沉淀,加热后无明显变化;
(2)B和C混合产生白色沉淀,加热后产生使湿润红色石蕊试纸变蓝的气体;
(3)B和E混合无明显变化,加热后产生使湿润红色石蕊试纸变蓝的气体。
根据以上现象,判断A、B、C、D、E各为什么物质:
A , B ,C ,D E 。
(Ⅰ)配平下列氧化还原反应方程 式:
式:
(Ⅱ)某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答: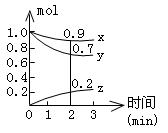
(1)计算反应开始2min内的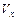 =,
=,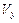 =,
=,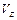 =,
=,
(2)容器内的反应物是。
(3)写出该反应的化学方程式。