下列溶液中粒子的物质的量浓度关系正确的是
| A.0.l mol·L-1的KHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| B.已知在相同条件下酸性HF > CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-) >c(K+)-c(CH3COO-) |
| C.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+) |
| D.CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
下列说法正确的是()
| A.置换反应一定是氧化还原反应 |
| B.NaCl在电流作用下电离产生了Na+和Cl- |
| C.某溶液滴加氯化钡溶液后生成白色沉淀,说明原溶液中有Ag+ |
| D.检验待测液中是否含有SO42-,应先加BaCl2,再滴加稀硝酸 |
关于下列实验说法正确的是()
A.利用该装置准确量取9.20mL浓硫酸 |
B.将洗涤液转移到容量瓶中,应该采取如图操作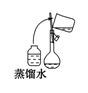 |
| C.过滤和蒸发中都要使用玻璃棒,且玻璃棒的用途一样 |
| D.保存NaOH应使用带橡皮塞的玻璃试剂瓶 |
在下列指定溶液中,离子一定能大量共存的是()
| A.加入H+有气体产生的溶液中:SO32-、Ba2+、K+、NO3- |
| B.使酚酞显红色的溶液中:NO3-、Cl-、K+、Ba2+ |
| C.加铁粉放出氢气的溶液中:Na+、H+、CH3COO-、Cl- |
| D.呈酸性的无色溶液中:K+、Fe2+、NO3-、SO42- |
已知在标准状况下6.72L某气体质量是8.4g,则该气体可能为()
| A.NH3 | B.NO2 | C.CO2 | D.CO |
下列叙述中,正确的是()
| A.同温同压下,等体积的气体所含有的原子数相同 |
| B.在氧化还原反应中金属单质作反应物时一定做还原剂 |
| C.发生离子反应,生成物要同时具备难溶物、难电离物质和挥发性物质三个条件 |
| D.盐酸中逐滴加入Na2CO3溶液和Na2CO3溶液中逐滴加入盐酸现象完全一样 |