能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
Ⅰ、煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) ∆H
CH3OH(g) ∆H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(∆H)分别为a、b、c,则上述反应的∆H= 。
(2)将1molCO和2molH2通入1L密闭容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| |
10min |
20min |
30min |
40min |
50min |
60min |
| 3000C |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 5000C |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
①在3000C反应开始10分钟内,H2的平均反应速率_____________。
②5000C平衡常数K=___________。
③在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为 。
(3)煤燃烧的主要产物CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSP=2.8×10-9mol2/L2。现将2×10-4mol/L的Na2CO3溶液与一定浓度的CaC12溶液等体积混合生成沉淀,计算应加入CaC12溶液的最小浓度为 。
Ⅱ、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2 △H
2CO2+ N2 △H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)(×10-4mol/L) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)( ×10-3mol/L) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”);
(2)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,部分实验条件如下表:
| 实验编号 |
T/℃ |
NO初始浓度/mol·L-1 |
CO初始浓度/mol·L-1 |
催化剂的比表面积/m2·g—1 |
| I |
280 |
1.2×10—3 |
5.8×10—3 |
82 |
| Ⅱ |
280 |
1.2×10—3 |
5.8×10—3 |
124 |
| Ⅲ |
350 |
1.2×10—3 |
5.8×10—3 |
124 |
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号。

化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器, 熟悉常见实验用品是正确进行实验的基础。试回答以下问题:
(1)现有如下仪器,用序号回答有关问题:
①容量瓶 ②蒸馏烧瓶 ③托盘天平 ④量筒 ⑤烧杯 ⑥蒸发皿 ⑦分液漏斗
对允许加热的仪器,加热时必须垫石棉网的有____________;使用时必须检查是否漏水的有____________;标有“0” 刻度的有______________。
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.蒸发 |
| C.结晶法 | D.过滤法 |
E.蒸馏法 F.洗气
①___________分离饱和食盐水和沙子的混合物;
②___________除去乙醇中的水;
③___________除去CO2中的H2O(气态);
④___________从碘的水溶液里提取碘;
(3)盛放氢氧化钠溶液的试剂瓶标签上应印有下列警示标记中的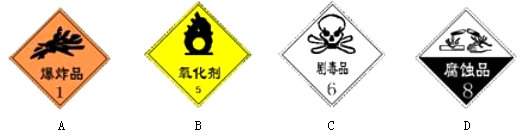
(每空2分,共8分)
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① |
HF |
Ka=6.8×10-4 mol•L-1 |
| ② |
CH3COOH |
Ka=1.7×10-5 mol•L-1 |
| ③ |
HCN |
Ka=6.2×10-10 mol•L-1 |
| ④ |
H2CO3 |
Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最弱的是_____________________。
(2)写出H2CO3电离方程式是 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________ ______,
少量的CO2通入NaCN溶液中:_________ _____。
(每空2分,共10分)
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于______________mol。
(每空2分,共6分)
某温度下水的离子积为KW =1×10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b= ;
(2)若所得混合液的pH=2,则a∶b= ;
(3)若所得混合液的pH=10,则a∶b= 。
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
请回答下列问题:
(1)固体a的化学式为__________________,Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为___________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__________________、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1)______________________L(保留4位有效数字)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为____________________。