【原创】常温下,下列有关叙述正确的是
| A.饱和氯水中滴加NaOH至溶液呈中性:c(Na+)=2c(ClO-)+c(HClO) |
| B.100ml 0.2mol/L的NH4Cl溶液和200ml 0.1mol/L的NH4Cl溶液所含有的n(NH4+)相同 |
| C.向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
| D.PH均为5的HCl、CH3COOH、NH4Cl溶液中水电离的氢离子c(H+)水顺序为NH4Cl>CH3COOH>HCl |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是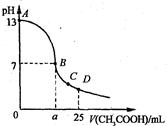
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml
将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是
| A.c(HCN) >c(CN—) | B.c(Na+)>c(CN—) |
| C.c(HCN)-c(CN—)=c(OH—) | D.c(HCN)+c(CN—)=0.1mol/L |
现有三种溶液各25mL:①Na2CO3;②NaHCO3;③NaOH,下列说法正确的是
| A.三者浓度相同时,pH大小顺序为③>②>① |
| B.三者浓度相同时,稀释相同倍数,pH变化最大的为② |
| C.三者的pH均为9时,物质的量浓度的大小关系为③>②>① |
| D.三者浓度相同时,分别加入同体积同浓度的盐酸后,pH最大的是① |
在甲酸的下列性质中,可以证明它是弱电解质的是
| A.1mol/L的甲酸溶液中c(H+)约为1×10-2 mol/L |
| B.甲酸能与水以任意比例互溶 |
| C.1mol/L的甲酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应 |
| D.甲酸溶液的导电性比盐酸弱 |