二氧化钛是钛的重要化合物,是一种白色颜料。工业上常用硫酸法从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,其流程如下:
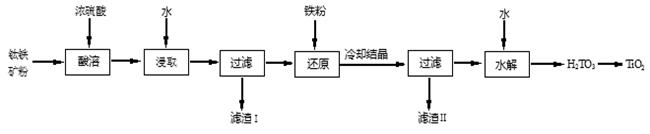
(1)流程中把钛铁矿石粉碎为钛铁矿粉的目的是 。
(2)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为 ;酸溶过程中浓硫酸过量除了使钛铁矿充分反应外还因为 。
(3)浸取液与铁屑反应的离子方程式为 ;滤渣Ⅱ主要成分的化学式为 。
(4)水解前溶液中存在TiO2+、SO42-等水解反应离子方程式为 。
T℃时,将3mol气体A和1mo1气体B通入容积为2L且固定不变的密闭容器中,发生如下反应:3A(g)+B(g) 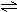 xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均速率为;X=;
(2)若向原平衡混合物的容器中再充入amolC,在T℃达到新的平衡,此时B的物质的量为n(B)=;
(3)保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡
向右移动的是;
A.均减半 B.均加倍 C.均增加0.4mol D.均减少0.4mol
(4)若上述可逆反应的热化学方程式为:
3A(g)+B(g) 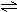 xC(g) ;△H =-QKJ/mol (Q>0)
xC(g) ;△H =-QKJ/mol (Q>0)
①若可逆反应达到平衡后升高体系温度,正反应速率(填“增大”、“减小”或“不变”),平衡将(填“左移”、“右移”或“不移动”)
②若可逆反应达到平衡后增大压强,则体系温度将(填“升高”、“降低”或“不变”)
③若可逆反应达到平衡后,加入A,则△H(填“变大”、“变小”或“不变”
已知具有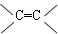 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2 HOCH2CH2OH,现以M(
HOCH2CH2OH,现以M( )为原料合成环状化合物F和高分子化合物E和G。
)为原料合成环状化合物F和高分子化合物E和G。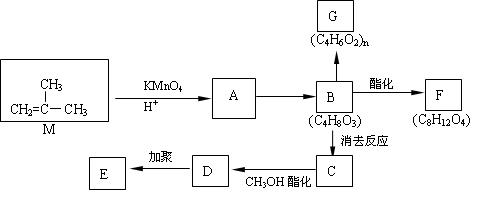
(1)有机物M的名称为;C中的官能团名称是;
A→B的反应类型是。
(2)①B→C的化学方程式。
②B→F的化学方程式。
③两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为。
④D→E的化学方程式。
(3)分子式为C9H10O2的芳香族化合物,属于酯类且只有一个侧连的同分异构体有
种,请写出任意两种的结构简式。
中学常见物质A~L的转化关系如下图:(无关产物已略去)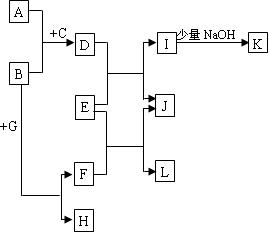
①A、B、H均为单质,A、B有金属光泽,A可以在常温下溶于L的浓溶液,H为黄色固体,向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气。
②D、E、F、I、L都是无色溶液,G是无色气体。
③K是一种白色沉淀,J是一种黄色沉淀,将G通入E后可以产生一种黑色沉淀和L。
(1)写出下列物质的名称:
ABH
(2)A和F也可以反应生成D,写出此化学反应方程式。
(3)写出试题中出现的几种沉淀的化学式:白色沉淀;黄色沉淀;黑色沉淀。
(4)写出电解E溶液的电极反应式阳极:;阴极:。
写出符合下列条件的元素原子的外围电子排布式:
(1)电负性最大的元素的原子______________。
(2)自然界中最活泼的金属元素的原子______________。
(3)第四周期0族元素的原子______________。
(4)能形成自然界中最硬的单质的元素原子______________。
用元素符号填空:
(1)第四周期中,原子的4p轨道半充满的元素是______________,3d轨道半充满的元素是______________。
(2)第三周期中有两个成单电子的元素是______________。