氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)污水中的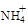 可以用氧化镁处理,发生如下反应:
可以用氧化镁处理,发生如下反应:
MgO+H2O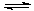 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+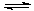 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。
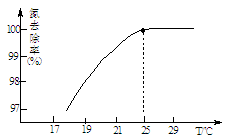
②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
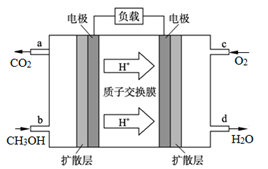
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
在实验室配制溶液时,常涉及以下过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解.
请按要求回答下列问题:
(1)甲同学用氯化钠和蒸馏水配制50 g 5%的氯化钠溶液.正确的操作顺序是:___________________.(用以上序号填空)现实验室中有10mL,50mL,100mL等不同规格的量筒,配制 上述溶液时最好选用_______mL的量筒.
(2)乙同学用10g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50g,5%的氯化钠溶液.正确的操作顺序是:____________________________.(用以上序号填空)
t1℃时硝酸钠的饱和溶液的质量分数为20%,已知t 2 ℃硝酸钠的溶解度为t 1 ℃时的溶解度的三倍,则t 2 ℃时硝酸钠饱和溶液的质量分数为______________.
将50 g 25%的氯化钾溶液与40 g 5%的氯化钾溶液混合所得溶液的质量分数为______________;若用20%和10%的氯化钾溶液配制200g12%的氯化钾溶液,需20%的氯化钾溶液__________g,10%的氯化钾溶液______________g.
在10℃时,氯酸钾的溶解度为5g,在该温度下的氯酸钾的饱和溶液中溶质、溶剂、溶液的质量比为______________.
用锌片与稀硫酸反应,实验结果记录如表
| 次数 |
加入Zn质量/g |
加入稀硫酸质量/g |
生成ZnSO 4 质量/g |
| 1 |
2 |
60 |
5 |
| 2 |
4 |
60 |
|
| 3 |
6 |
60 |
15 |
| 4 |
8 |
60 |
17 |
| 5 |
10 |
60 |
|
| 6 |
12 |
60 |
17 |
(1)第2、5两次产生ZnSO4 的质量依次是______________g.
(2)在图中画出ZnSO4 与Zn的质量函数关系的曲线. 
(3)(10+m)g锌与60g稀硫酸充分反应后,剩余固体的质量为______________g.
(4)稀硫酸的溶质质量分数是______________.