本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.[物质结构与性质]原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与未成对电子数相等;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F+基态的核外电子排布式为 。
(2)BA3-的空间构型为 ;1molAD2中含有π键的数目为 。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(4)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
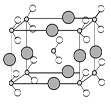
写出下列反应的离子方程式。
①稀硫酸与NaOH溶液反应的离子方程式:
________________________________________________________________________
②足量稀硝酸与CaCO3溶液反应的离子方程式:
________________________________________________________________________
③锌与稀硫酸反应的离子方程式:
________________________________________________________________________
④稀硫酸和氢氧化钡溶液反应的离子方程式:
⑤等体积等物质的量浓度的碳酸氢钠溶液和氢氧化钡溶液反应的离子方程式:
标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积为,一氧化碳的质量为。
①等物质的量的CO和CO2所含原子个数比为,质量比为。
②含硫原子数相同的SO2和SO3的物质的量之比是;含氧原子数相同的SO2和SO3的质量之比是,物质的量之比是。
下列几种物质:①H2O、②空气、③Mg、④CaO、⑤盐酸溶液、⑥Ca(OH)2、⑦C2H5OH、⑧蔗糖,属于电解质的是,属于强电解的是,属于非电解质的是。
相同条件下,H2、N2两种气体按体积比为2∶1的比例混合,所得混合气体中N2质量为1.4g,问:
(1)该混合气体的总质量为____________________
(2)该混合气体在标准状况下的体积为_______________
(3)该混合气体的平均分子量______________________(保留一位小数)