【化学—选修3物质结构与性质】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3(保留两位小数)。

在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的材料;硅酸钠水溶液俗称为,是制备硅胶和木材防火剂的原料;陶瓷、、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是;漂白液有效成分的化学式为。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:
②NO2气体通入水中:
③水既作氧化剂又作还原剂:
金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为:
(2)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是(填化学式,下同);适宜做耐火材料的是;
(3)金属铝既能与盐酸反应,又能与烧碱溶液反应,请写出金属铝与烧碱溶液反应的离子方程式:。
(4)取少量FeCl2溶液,按图所示操作,使其跟NaOH溶液反应。可观察到试管中出现白色絮状沉淀,继而变成灰绿色,最后变成红褐色,请写出与上述现象相关的反应的化学方程式:、。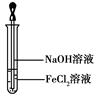
(5)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是(填序号)。
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可
使酚酞变红,它们之间的转化关系如下图①所示:
(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有(填序号)
①放热②黄绿色褪去③瓶口有白雾④瓶口有白烟
⑤安静燃烧,发出黄色火焰⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是(填序号)。
①D气体不能用排水法收集
②干燥管里盛有碱石灰
③图②中的a为棉花团,其作用是防止氨气逸出
(4)气体D催化氧化的化学方程式为。
(5)物质E的化学式是;E在下列物质分类中所属的物质种类是(填序号)。
①电解质;②化合物;③混合物;④纯净物;⑤非电解质;⑥盐
将5.5 g铁铝混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。
(2)若a=3.36L(标准状况),则混合物中铝的质量分数为_________%。
(3)若a=3.36L(标准状况),往反应后的溶液中加入___________ mL 1.000 mol/L NaOH溶液时生成的沉淀量最大,还要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不变。
某些化学反应可用下式表示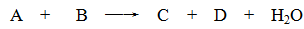
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是。
(3)若A、C均含有铝元素。①当B是盐酸时,C是;②当B是NaOH时,C是。