[化学—选修5:有机化学基础](15分)脱水偶联反应是一种新型的直接烷基化反应,例如,反应①:
(1)化合物Ⅰ中含有的官能团的名称为_______,1 mol该物质完全水解最少需要消耗_______mol NaOH。
(2)化合物Ⅱ可使________溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物Ⅱ,相应的反应类型为________。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1∶1∶1∶2,Ⅳ的结构简式为________。
(4)化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ。Ⅵ的结构简式为________。检验Ⅵ中所含官能团,按使用的先后顺序写出所用试剂_________________________________。
(5)一定条件下, 与
与 也可以发生类似反应①的反应,有机产物的结构简式为______________________________________。
也可以发生类似反应①的反应,有机产物的结构简式为______________________________________。
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1)实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式:。
工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应后生成碘,写出此反应的离子方程式:。
(2)单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O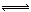 H3O++OH-),生成的阳离子为IF4+,则阴离子为。
H3O++OH-),生成的阳离子为IF4+,则阴离子为。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体(AlI3),此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出AlI3和Na2CO3溶液反应的离子方程式:。
(4)设计以下实验方案判断加碘食盐中碘的存在形式为I-、IO3-,或两者同时存在。请对以下试验方案进行预测和分析。
首先取试样加水溶解,分成三份试样:
①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO3-,该过程反应的离子方程式为。
②第二份试样酸化后加溶液,如果加入淀粉溶液后试样溶液变蓝,说明试样中存在I-。
③第三份试样酸化后,如果直接使试纸变蓝,说明试样存在IO3-离子。
(选做15分)硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
请回答下列问题:
(1)下列物质中最适合的氧化剂B是;
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
反应的离子方程式。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液? 并说明理由。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量 NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是()
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为(标况下).
Q、W、X、Y、Z为五种原子序数依次增大的短周期元素。已知:
①Q原子的核外电子数等于电子层数,且与W组成的一种化合物是沼气的主要成分;
②元素X的最高价氧化物的水化物和其气态氢化物能够反应,生成离子化合物甲;
③W与Y组成的化合物乙,是机动车排出的大气污染物之一,也是造成“雾霾”天气的物质之一;
④Y与Z能形成电子总数为30和38的两种离子化合物,分别为丙和丁
(1)丁的电子式是 __________。
(2)WY2与Z2Y2反应的化学方程式是_________________________________________。
(3)甲在水溶液中的水解方程式为______________________________________。
(4)写出一种实验室制取XQ3的方法__________________________________。(用化学方程式表示)
(5)标准状况下22.4L X的气态氢化物,与0.5L 1mol/L的X最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是________________________________________(用化学式表示)。
(14分)(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
①判断甲容器中的反应达平衡的依据是。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (初始压强用P0表示)。
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= 。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)____ C(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为。
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为。