下述实验不能达到预期实验目的是
| 序号 |
实验内容 |
实验目的 |
| A |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
检验Fe(NO3)2晶体是否已氧化变质 |
| B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加NaI溶液 |
验证Ksp(AgCl)>Ksp(AgI) |
| C |
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
比较确定铜和镁的金属活动性强弱 |
| D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
已知Cl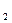 可溶于水,并发生如下反应:Cl
可溶于水,并发生如下反应:Cl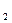 +H
+H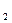 O
O HCl+HClO。对此,下列说法错误的是()
HCl+HClO。对此,下列说法错误的是()
| A.该反应是氧化还原反应 |
B.氯气(Cl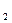 )是氧化剂,水(H )是氧化剂,水(H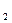 O)是还原剂 O)是还原剂 |
| C.该反应不属于置换反应 |
D.Cl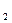 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
黑火药的爆炸反应方程式可表示为:
2KNO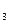 +S+3CK
+S+3CK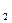 S+N
S+N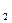 ↑+3CO
↑+3CO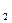 ↑
↑
其中氧化剂是()
| A.C | B.KNO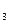 |
C.KNO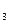 和S 和S |
D.S |
下列各组溶液之间的反应,所用离子方程式表示相同的是( )
| A.硝酸钡与稀硫酸,氯化钡与硫酸钠 |
| B.盐酸与碳酸钠,盐酸与碳酸氢钠 |
| C.氢氧化钠与硫酸,氢氧化钡与硫酸 |
| D.氢氧化钠与盐酸,氢氧化钾与醋酸 |
根据物质所属的类别及同类别物质的性质规律,利用类比的方法类推物质的可能性质是重要的科学方法,而准确判断物质所属的物质类别是这一方法的前提。下列物质属于强电解质的是()
A.Ba(OH) |
B.NH ·H ·H O O |
| C.Cu | D.CH COOH COOH |
下列物质不能导电的是()
| A.氢氧化钠溶液 | B.醋酸溶液 |
| C.熔融氯化钾 | D.FeSO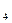 晶体 晶体 |