研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1 ;则CO还原Fe2O3(s)的热化学方程式为
| A.Fe2O3+ 3CO=2Fe+ 3CO2 △H=-28.5 kJ·mol-1 |
| B.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ |
| C.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H= + 28.5 kJ·mol-1 |
| D.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1 |
下列各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为( )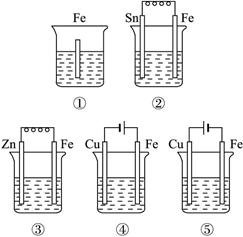
图1
| A.①②③④⑤ | B.②①③④⑤ | C.④②①③⑤ | D.④⑤①②③ |
某固体化合物A不导电,但熔化或溶于水都能完全电离,下列关于物质A的说法正确的是( )
| A.A为非电解质 | B.A是强电解质 | C.A是离子化合物 | D.A为弱电解质 |
把镁带投入盛有稀HCl的容器里,产生H2的速率与下列因素有关系的是( )
①盐酸浓度②温度③镁带的表面积④容器的密闭情况⑤溶液的氯离子浓度
| A.①② | B.③④ | C.①②③④ | D.①②③④⑤ |
下列措施肯定能使化学反应的反应速率增大的是( )
| A.增大反应物的量 |
| B.增大压强 |
| C.升高温度 |
| D.使用正催化剂 |
在相同温度时,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
| A.中和时所需NaOH的量 |
| B.电离度 |
| C.H+的物质的量 |
| D.CH3COOH的物质的量 |