用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是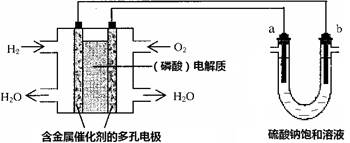
| A.电池工作时,正极反应式为:O2 + 4H++ 4e- ="=" 2H2O |
B.电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是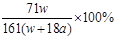 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2 |
下列关于硅元素及其化合物的有关说法正确的是
| A.硅在自然界中既有游离态又有化合态 |
B.SiO2+3C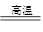 SiC+2CO↑中碳只做还原剂 SiC+2CO↑中碳只做还原剂 |
| C.因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
| D.SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
从下列实验事实所得出的相应结论不正确的是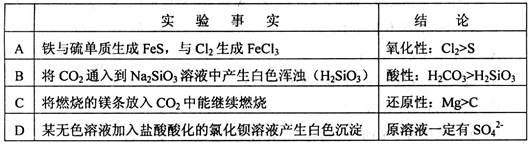
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O和18O的物理性质和化学性质完全相同 |
| B.通过化学反应可以实现16O与18O的相互转化 |
C.向2SO2(g)+ O2(g) 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 |
| D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
下列关于有机物结构、性质的说法正确的是
| A.石油的分馏和煤的干馏都是化学变化 |
| B.分子式为C3H7C1的有机物有三种同分异构体 |
| C.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 |
| D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
NA代表阿伏加德罗常数的值。下列有关叙述正确的是
| A.含有NA个氮气和乙烯分子的混合气体质量为28g |
| B.标准状况下,11.2L氦气中含有NA个氦原子 |
| C.将NA个NH3分子溶于lL水中得到lmol/L的氨水 |
| D.100mL 0.1mol/LAlCl3溶液含有0.01NA个A13+ |