KCl与KNO3在不同温度的溶解度数据如下表。回答:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
| KCl(g/100g水) |
30 |
33 |
35 |
38 |
41 |
| KNO3(g/100g水) |
21 |
31 |
45 |
65 |
88 |
①从表中数据可以看出KCl与KNO3的溶解度随温度升高而 (填“增大”或“减小”)。若硝酸钾饱和溶液中有少量的KCl,可用 的方法提纯KNO3。
②KCl与KNO3两物质的溶解度相等的温度在_ _ (填序号)。
A.10℃~20℃间 B.20℃~30℃间
C.30℃~40℃间 D.40℃~50℃间
③30℃时,将15gKCl固体投入50g水中,充分溶解后可得到KCl的 溶液(填“不饱和”或“饱和”或“不能确定”)。
④某温度时,向100g 30% KNO3溶液中加入40g KNO3固体,溶液恰好饱和,则此温度KNO3的溶解度为 ,关于该饱和溶液的叙述正确的是_ _(填序号)。
A.降温后,溶液质量减少
B.加水稀释,溶液中溶质质量不变
C.升温后,溶液中溶质质量分数不变
D.m(溶质)∶m(溶液)=3∶10
化学就在我们身边,它能改善我们的生活。现有氮气、干冰、盐酸、氢氧化钠、硝酸钾五种物质,请用化学式填空:
(1)俗称烧碱的是________;
(2)农田施用的复合肥料是________;
(3)可用于人工降雨的是________;
(4)人体胃液中含有的成分是________;
(5)充入食品包装袋内用于防腐的是________。
A~G均为初中化学中常见的物质。其中A、C组成元素相同,E是红色单质。下图是它们之间的转化关系,请回答: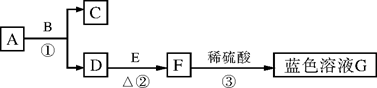
(1)写出反应①的化学方程式:__________________________,其中B物质在该反应中起________作用;
(2)反应②中的现象为________________________;
(3)反应③的基本类型是__________反应。
某同学在敞口容器中做了两个实验:一是氧化汞(HgO)受热分解生成汞和氧气;二是铝粉在氧气中燃烧生成固体氧化铝。他准确称量了反应前后容器及所盛物质的质量,发现反应前后质量都发生了变化。请填空:
(1)铝粉燃烧生成氧化铝的质量比参加反应铝粉的质量________(选填“大”、“小”或“不变”)。
(2)你认为这两个反应是否遵循质量守恒定律?________(选填“是”或“否”)。
(3)请写出氧化汞受热分解的化学方程式___________________________________。
请根据物质的组成、结构、性质之间的关系,回答下列问题:
(1)铜可用作电线,原因是__________________________________________;
(2)CaO能与H2O反应,可用于________________________________;
(3)H2O与H2O2的元素组成相同,但化学性质不同,原因是__________________________。
2011年湖北等省遭遇了50年一遇的严重干旱,旱灾地区的饮用水问题备受关注。漂白粉是旱灾地区应急饮用水常用的消毒剂,其主要成分是氯化钙(CaCl2)和次氯酸钙[Ca(ClO)2]。回答下列问题:
(1)为缓解旱情,气象部门适时实施人工降雨,下列物质可用于人工降雨的是__________(填序号)。
A.干冰 B.CO C.冰D.水
(2)漂白粉属于__________(填序号)。
A.化合物B.单质 C.纯净物 D.混合物
(3)家用漂白粉的消毒原理是漂白粉中的次氯酸钙[Ca(ClO)2]与水和空气中的CO2反应生成了次氯酸(HClO)和另一种物质,次氯酸具有杀菌消毒作用。试写出次氯酸钙[Ca(ClO)2]与水和CO2反应的化学方程式:____________________________________。