有一瓶未知浓度的氢氧化钠溶液,同学们想用10%的稀盐酸来测定其溶质的质量分数。以下是两组同学的设想及做法:
①甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入2滴酚酞溶液,用滴管慢慢滴入10%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。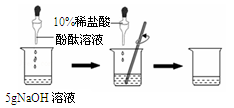
请回答:
酚酞溶液的作用是 ⑿ 边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 ⒀ 。
当溶液颜色恰好变为无色时,共用去了稀盐酸14.6g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为
⒁ (写出计算过程,结果用百分数表示)。
②乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入10%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
下列使用pH试纸的方法正确的是 ⒂ (填字母)。
| A.将pH试纸剪成几段节约使用 |
| B.将pH试纸直接插入待测液中 |
| C.将pH试纸放在干净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上 |
| D.将pH试纸润湿后放在干净的表面皿上,用玻璃棒蘸取待测液滴在pH试纸上 |
在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。他们通过进一步实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。请你根据他们的实验步骤写出实验现象:
| 实验步骤 |
现 象 |
结 论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
⒃ |
NaOH溶液部分变质 |
若要除去溶液中变质生成的杂质,请简要写出实验方案 ⒄ 。
氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用加热氯化铵与氢氧化钙固体混合物来制取氨气。
(1)请你从图甲中选择实验室用此方法制取氨气的发生装置。
(2)若用C装置收集氨气,则气体要从_______(填“a”或“b”)进入集气瓶。
(3)闻氨气时,在操作上应注意什么问题?
(4)图乙是利用氨气做的一个趣味实验(夹持设备已略去),烧瓶中装有干燥的氨气,胶头滴管中装有水,先关闭阀门,将胶头滴管中的水挤入烧瓶内,然后打开阀门,请你描述烧瓶中可能出现的现象。
(6分)认识燃烧,科学地利用燃烧,使燃烧为人类服务是十分重要的。
为验证可燃物燃烧的条件,某兴趣小组进行了如下探究活动。
[查阅资料]白磷的着火点是40℃,红磷的着火点是240℃,两种物质
的燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,能与空气中
的水蒸气反应,生成有毒的偏磷酸(HPO3)。
[设计实验]小组同学设计了下图的实验装置进行实验。
[收集证据]实验中获得了如下实验事实:
①A试管内的白磷燃烧;②热水中的白磷不燃烧;③B试管内的红磷不燃烧。
[得出结论]结论1:依据上述实验事实(选填序号)可知:可燃物
燃烧需与氧气接触。
结论2:依据上述实验事实①③可知:可燃物燃烧需满足的条件是。
[拓展延伸]若将A试管上带玻璃管的橡皮塞换成实心橡皮塞,在实验中可能会发生的问题是:;若去除A试管上带玻璃管的橡皮塞,在实验中又可能会出现的问题是: 。
[知识运用]我国的成语蕴含着丰富的化学知识。下面是一些与燃烧有关的成语的文学解释,请根据燃烧的条件和灭火的原理解释以下成语的化学含义。
煽风点火:比喻煽动别人闹事。;
釜底抽薪:抽去锅底下的柴火,比喻从根本上解决问题。。
某工厂现有含少量铁屑的铜屑废料。某校九(5)班化学兴趣小组的同学欲从中回收铜,他依据“绿色化学”的思想设计了两种方案:
方案Ⅰ(物理方法):将磁铁接触铁屑和铜屑混合物,铜和铁分别得到回收……
方案Ⅱ (化学方法): 过程如下:
①操作A的名称是,完成该操作需要的玻璃仪器有烧杯、漏斗和;
②B可能为 ___________;写出相关的化学方程式_____________________________;
③确定给铁屑和铜屑加入的B已经过量的方法有:___________________。
④该方案体现绿色化学的思想有:铜得到了回收,。
某活动小组的同学查阅资料得知,传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐。小组同学将这三种物质混合后加入适量的水搅拌、过滤得滤渣和滤液,对滤液中溶质的成分进行探究:
【猜想与假设】甲同学认为:可能是NaCl、Na2C03、Ca(OH)2
乙同学认为:可能是NaCl、NaOH、Na2C03
丙同学认为:可能是NaCl、NaOH、Ca(OH)2
丁同学认为:可能是NaCl、NaOH
【交流与评价】经过讨论,大家一致认为______同学的猜想不合理。理由一是_________________;理由二是_______________________________
【活动与探究】乙同学取原滤液向其中倾倒一定量的稀盐酸观察到有大量气泡产生,于是得出该滤液中的溶质是NaCl、NaOH、Na2C03的结论,证实了自己的猜想。
丙同学取原滤液向其中加入Na2C03溶液无现象,据此否定了自己的猜想;他又
重新取原滤液,向其中加入CaCl2溶液观察到_________________,得出了和乙同学相同的结论。
丁同学为了验证上述结论也取原滤液向其中滴加了少量稀盐酸,却发现无气泡产生。
【解释与结论】大家经过分析找出了丁同学所用试剂与乙同学相同,却没有看到气泡的原因。你认为可能的原因是________________________________________。经过上述四位同学的共同努力,大家终于对滤液中溶质的成分得出了正确结论。
小明、小华和小林三位同学利用下图所示装置在实验室制取O2和CO2,并对它们的有关性质进行研究,请回答下列问题。
(1)小明同学用KMnO4固体制取O2,应选用上图中的 装置(填编号),
该反应的化学方程式为 ;当O2收集满并取出集气瓶后,停止该实验的正确操作方法是 。
(2)小华同学用浓HCl与大理石在C装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象的解释不合理是 (填序号)。
a.产生的CO2直接使石蕊试液变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
c.挥发出的氯化氢溶于水,使石蕊试液变红
(3)小林同学用A装置制取了一瓶无色无味纯净的气体,他制取的气体可能是 ,
试用最简便的方法验证他所制取的气体 。