(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g) 2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K |
298 |
398 |
498 |
…… |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
…… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为: ;
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为__ ;
(3)COCl2的分解反应为COCl2(g)= Cl2(g)+ CO(g) △H =" +108" kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
①计算反应在第8 min时的平衡常数K = __________(保留小数点后三位)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v (2—3)、v(5—6)、v (l2-13)表示]的大小___________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:v (5-6) v(15-16)(填“<”、“>”或“=”),原因是____________。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的负极为 ,正极反应式为 ,
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn g(已知F=96500C/mol)。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过 分离回收,滤渣的主要成分是二氧化锰、 和 ,欲从中得到较纯的二氧化锰,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为 加碱调节PH为 ,铁刚好完全沉淀(离子浓度≤1×10-5mo1·L-1时即可认为离子沉淀完全)继续加碱调节PH为 锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1 mo1·L-1)。若上述过程不加双氧水的后果 ,原因是 。
某饮料果醋的成分之一M的结构简式为: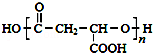 ,合成M的流程图如下:
,合成M的流程图如下: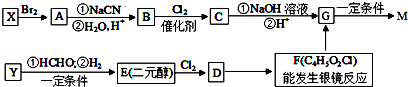
已知:①X、Y都是烃,在核磁共振氢谱图上都只有一个峰
②RC≡CH+HCHO RC≡C﹣CH2OH
RC≡C﹣CH2OH
③RCH2Br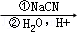 RCH2COOH
RCH2COOH
请回答下列问题:
(1)有机物C的系统命名为 。
(2)实验室制备Y的化学方程式为 。由F制G可能发生的有机反应类型为 。
(3)D含有的官能团名称是 。
(4)写出下列反应的化学方程式
①由G制备M 。
②F和足量的碱性新制氢氧化铜悬浊液 。
(5)T是G的同分异构体,T含有三种含氧官能团:羧基、羟基和醛基,两个羟基不连在同一个碳原子上。写出T可能的结构简式 。
(15分) A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 ="578" kJ/mol,I2="1" 817 kJ/mol,I3=" 2" 745 kJ/mol,I4 ="11" 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。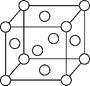
氮和硫的化合物对大气都有严重污染,据所学化学反应原理回答下列问题:
(1)NO2与悬浮在大气中海盐粒子的相互作用时发生反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)∆H =" a" KJ/mol
NaNO3(s)+ClNO(g)∆H =" a" KJ/mol
则该反应为 反应(填放热或吸热),产物ClNO的结构式为 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)若将SO2,NO2,O2按4:4:3通入水中充分反应,写出总的离子方程式 。
(4)向氨水中通入过量的H2S,所得溶液M中溶质的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)