聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)滤渣Ⅰ的主要成分为 (填化学式);若通入足量的二氧化碳,滤液的主要溶质为 (填化学式)。
(2)“酸溶Ⅰ”时发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式是 。“氧化”时应控制温度不超过57℃,其原因是 。
(4)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是 。
(1)请用“>”、“<”或“=”填写下列空格:
①已知:Zn(s)+CuSO4(aq)==ZnSO4(aq)+Cu(s)ΔH="-216" kJ·mol-1,则E反应物E生成物
②由A、B两金属作电极,硫酸溶液作电解质溶液,形成原电池,电流由A极经外电路流向B极,则金属活泼性AB
③镀层破损后铁的腐蚀速度比较:镀锌铁管镀锡铁管
(2)用“增大”、“减小”或“不变”填写下列空格:
④以石墨为电极电解Na2SO4溶液时,电解过程中阳极区溶液的pH
⑤某温度下,可逆反应A(s)+ B(g) 2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: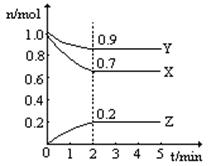
(1)该反应的化学方程式是;
(2)从开始至2min,NH3的平均反应速率是;
(3)用电子式表示X的形成过程___________________ __ __;
(4)第4分钟时下列叙述正确的是;
| A.该反应已停止 | B.该反应为可逆反应 |
| C.3v(H2)=2v(NH3) | D.c(H2):c(N2):c(NH3)=" 7" :9 :2 |
(5)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1mol N2与H2反应完全转化为NH3应_________热量(填“吸收”或“放出” )。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间(秒)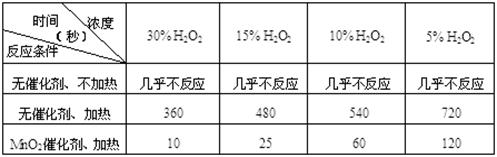
①研究小组在设计方案时,考虑了浓度、、等因素对过氧化氢分解速率的影响。
②上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下: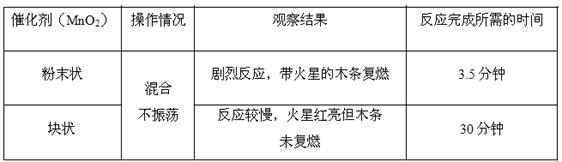
①写出H2O2发生的化学反应方程式。
②实验结果说明催化剂作用的大小与有关。
原电池是将能转化为能。其中,电子流出的一极是原电池的极,电子流入的一极是原电池的极,原电池的负极发生反应。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式,该化合物是由(填“极性”或“非极性”)键形成的。