(选做)【化学—化学与技术】煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:

这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中 得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)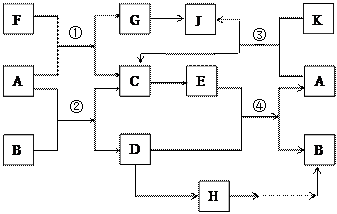
(1)写出下列物质的化学式B______, F_______, H______。A和G的最简单气态氢化物中,较稳定的物质是(填化学式),写出反应①的化学方程式。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)
(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G="1:1" B.反应②:A:D=1:1
C.反应③:A:J="2:1" D.反应④:E:B =1:1
已知2A(g)+B(g)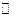 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a ▲b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ▲T2(填“>” “=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 ▲(填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 ▲(用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 ▲。
A. 4molA和2molB B. 4molA、2molB和2molC
C. 4molA和4molB D. 6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 ▲。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d ▲b(填“>”“=”或“<”),理由是 ▲。
⑹ 在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 ▲(填“不变”“变大”“变小”或“无法确定”)。
2010年诺贝尔物理学奖被两位英国科学家盖姆和诺沃肖格夫摘得,他们用普通胶带成功地从铅笔芯地石墨中分离出了石墨烯(分子式设为Cx),突破性地创造了撕裂法:他们将石墨分离成小的碎片,从碎片中剥离出较薄的石墨薄片,然后用胶带粘住薄片的两侧,撕开胶带,薄片也随之一分为二,不断重复这一过程,最终得到了截面约100微米的、只有单层碳原子的石墨烯。这种“只有一层碳原子厚的碳薄片”,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料。这种比最好的钢铁还要硬100倍、比钻石坚硬的石墨烯其实就是石墨的二维结构。其超强硬度、韧性和出色的导电性使得制造超级防弹衣、超轻型火箭、超级计算机不再是科学狂想。
⑴下列说法不正确的是 ▲。
A.石墨烯被公认为目前世界上已知的最薄、最坚硬的新型材料,所以他属于原子晶体
B. 石墨烯与金刚石互为同素异性体
C. 若该撕裂法可看做是将石墨结构内层与层间分离开,则此过程中必有共价键被破坏
D. 石墨烯晶体内最小环上有6个原子
E. 石墨烯可看做是芳香烃类的物质
F. 石墨烯晶体在一定条件下可发生加成反应
⑵石墨烯可能具有较强的 ▲(填“氧化性”或“还原性”),因此在足量空气中煅烧可能发生的反应方程式为 ▲。
⑶石墨烯之所以能导电,可认为主要是因为其每个碳原子成键后还有一个单电子,这些单电子均可与最近的3个碳原子中任意一个碳原子形成共价键,也就是说具有该结构的物质一般具有导电性,据此类推下列物质不具有导电性的是 ▲。
A. 石墨 B. 聚乙炔 C. 聚1,3-丁二烯 D. 聚苯乙炔
⑷ 18g石墨烯晶体内含有的碳原子数为 ▲,所含的碳碳单键数为 ▲。
某有机物甲和A互为同分异构体,经测定它们的相对分子质量小于100;将1mol甲在O2中充分燃烧得到等物质的量的CO2和H2O (g) ,同时消耗112LO2(标准状况);在酸性条件下将1 mol甲完全水解可以生成1 mol 乙和1mol丙;而且在一定条件下,丙可以被连续氧化成为乙。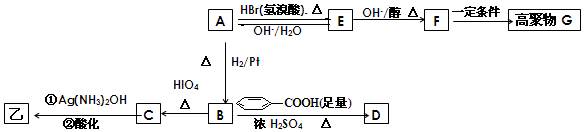
经红外光谱测定,在甲和A的结构中都存在C=O双键和C-O单键,B在HIO4存在并加热时只生成一种 产物C,下列为各相关反应的信息和转化关系:
产物C,下列为各相关反应的信息和转化关系: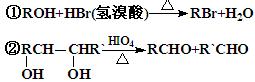
⑴ 请确定并写出甲的分子式 ▲;与甲属同类物质的同分异构体共有 ▲种(包含甲)。
⑵ E → F 的反应类型为 ▲反应;
⑶ A的结构简式为 ▲;G 的结构简式为 ▲;
⑷ B →D的反应化学方程式为 ▲;
⑸ 写出C在条件①下进行反应的化学方程式 ▲。
已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
(1)A分子的空间构型为 ;Y在周期表中的位置 ;
(2)写出气体D通入水中的化学反应方程式________________________;
(3)E具有不稳定性,因此实验室中保存E的方法是 ;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式: ,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为 L。